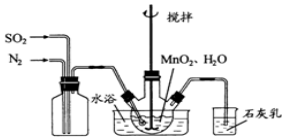
题目内容
20.下列化学用语正确的是( )| A. | HCl的电子式 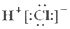 | B. | Cl-的结构示意图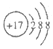 | ||
| C. | CO2的电子式 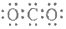 | D. | 质量数为37的氯原子 ${\;}_{37}^{17}$Cl |
分析 A.氯化氢为共价化合物,分子中不存在阴阳离子;
B.氯离子的核电荷数为17,最外层达到8电子稳定结构;
C.二氧化碳分子中应该含有2个碳氧双键,不是C-O单键;
D.元素符号的左上方为质量数、左下角为质子数.
解答 解:A.氯化氢为共价化合物,氯原子最外层达到8个电子稳定结构,氯化氢正确的电子式为 ,故A错误;
,故A错误;
B.Cl-的核电荷数为17,核外电子总数为18,其离子结构示意图为: ,故B正确;
,故B正确;
C.CO2是共价化合物,其结构式为O=C=O,碳原子和氧原子之间有2对电子,其电子式为 ,故C错误;
,故C错误;
D.氯原子的质子数为17,质量数为37的氯原子的正确表示方法为:1737Cl,故D错误;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及电子式、元素符号、离子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的分析能力及规范答题能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.四种短周期X、Y、Z、W在元素周期表中的位置如图所示.已知X、Y、Z三种元素的原子最外层电子数之和为15.下列说法正确的是( )
| X | Z | |
| Y | W |
| A. | X是第ⅢA元素,Z是第ⅤA元素 | |
| B. | 原子半径大小关系:r(Y)<r(W) | |
| C. | Y的气态氢化物比Z的气态氢化物稳定 | |
| D. | X、Y、W三种元素的最高化合价依次升高 |
11.下列有关粒子的表示方法正确的是( )
| A. | CO2的结构式:O=C=O | B. | CH4的球棍模型: | ||
| C. | H2O的电子式: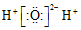 | D. | C2H4的结构简式:CH2=CH2 |
8.请按要求填写下列空白:
(1)写出含有10e-且呈正四面体结构的分子的名称甲烷;
(2)写出含有16e-的烃分子的电子式 ;
;
(3)写出含有18e-常温下呈液态且具有强氧化性的分子的结构式H-O-O-H.
(1)写出含有10e-且呈正四面体结构的分子的名称甲烷;
(2)写出含有16e-的烃分子的电子式
 ;
;(3)写出含有18e-常温下呈液态且具有强氧化性的分子的结构式H-O-O-H.
5.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 能与铝反应放出氢气的溶液中:K+、SO42-、NO3-、NH4+ | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
12.四种短周期元素W、X、Y、Z的原子序数依次递增,可形成简单离子W2-、X+、Y3+、Z2-.下列说法不正确的是( )
| A. | Y单质能溶于X元素的最高价氧化物的水化物 | |
| B. | W2能与H2Z发生置换反应 | |
| C. | 离子半径由大到小:Z2->X+>Y3+>W2- | |
| D. | W、X形成两种离子化合物,阴、阳离子个数比一定是1:2 |
14.臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性.实验室可将氧气通过高压放电管来制取臭氧:3O2$\frac{\underline{\;放电\;}}{\;}$2O3.
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为35.6 g•mol-1(保留一位小数).
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为3 L.
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g.则原混合气中臭氧的体积分数为50%.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠,通过计算,分析和比较上表3组数据,给出结论.
(1)若在上述反应中有30%的氧气转化为臭氧,所得混合气的平均摩尔质量为35.6 g•mol-1(保留一位小数).
(2)将8L氧气通过放电管后,恢复到原状况,得到气体6.5L,其中臭氧为3 L.
(3)实验室将氧气和臭氧的混合气体0.896L(标准状况)通入盛有20.0g铜粉的反应器中,充分加热后,粉末的质量变为21.6g.则原混合气中臭氧的体积分数为50%.
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
 乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.
乙醇是一种重要的有机化工原料,它可以用玉米、薯类等为原料发酵、蒸馏制成.乙醇和汽油经加工处理形成的车用燃料即乙醇汽油.