题目内容
5.某研究所组装的CH3OH-O2燃料电池的工作原理如图1所示.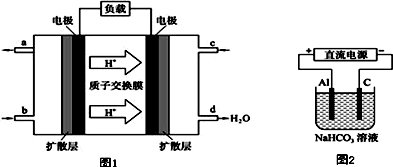
①该电池负极的电极反应式为:CH3OH-6e-+H2O=CO2↑+6H+.
②以此电池作电源进行电解,装置如图2所示.发现溶液逐渐变浑浊并有气泡产生,其原因是Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+3CO2↑(用相关的离子方程式表示).
分析 ①甲醇发生氧化反应,在负极反应,正极是氧气在反应,注意电解质是酸性的,据此书写电极反应式;
②阳极上铝失电子生成铝离子,铝离子和碳酸氢根离子发生双水解反应.
解答 解:①氢离子向右移动,说明右面的电极是正极,故甲醇应从b也就是负极通入,负极上甲醇发生失电子的氧化反应,在酸性条件下,电极反应式应为:CH3OH-6e-+H2O=CO2↑+6H+.
故答案为:CH3OH-6e-+H2O=CO2↑+6H+;
②铝作阳极,阳极上电极反应式为Al=Al3++3e-;阳极上生成的铝离子和碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,所以溶液变浑浊Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+3CO2↑.
点评 本题考查学生原电池的工作原理以及应用方面的知识,属于综合知识的考查,注意电解质环境以及电极反应式书写之间的关系,难度中等.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
18.下列说法正确的是( )
| A. | 非自发进行的反应一定不能发生 | |
| B. | 在一定条件下,非自发进行的反应也能进行 | |
| C. | 自发进行的反应一定迅速 | |
| D. | 凡是熵增加的过程都是自发过程 |
13.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:
WO3 (s)+3H2 (g) $\stackrel{高温}{?}$W (s)+3H2O (g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应吸热(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
第一阶段反应的化学方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;580℃时,固体物质的主要成分为W2O5、WO2;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为1:1:4.
(4)已知:温度过高时,WO2 (s)转变为WO2(g);
WO2 (s)+2H2 (g)═W (s)+2H2O (g);△H=+66.0kJ•mol-1
WO2 (g)+2H2(g)═W (s)+2H2O (g);△H=-137.9kJ•mol-1
则WO2 (s)═WO2 (g) 的△H=+203.9 kJ•mol-1.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s)+2I2 (g)$?_{约3000℃}^{1400℃}$WI4 (g).下列说法正确的有ab.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
WO3 (s)+3H2 (g) $\stackrel{高温}{?}$W (s)+3H2O (g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应吸热(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
(4)已知:温度过高时,WO2 (s)转变为WO2(g);
WO2 (s)+2H2 (g)═W (s)+2H2O (g);△H=+66.0kJ•mol-1
WO2 (g)+2H2(g)═W (s)+2H2O (g);△H=-137.9kJ•mol-1
则WO2 (s)═WO2 (g) 的△H=+203.9 kJ•mol-1.
(5)钨丝灯管中的W在使用过程中缓慢挥发,使灯丝变细,加入I2可延长灯管的使用寿命,其工作原理为:W (s)+2I2 (g)$?_{约3000℃}^{1400℃}$WI4 (g).下列说法正确的有ab.
a.灯管内的I2可循环使用
b.WI4在灯丝上分解,产生的W又沉积在灯丝上
c.WI4在灯管壁上分解,使灯管的寿命延长
d.温度升高时,WI4的分解速率加快,W和I2的化合速率减慢.
20.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA | |
| B. | 一定温度下,1 L 0.50 mol•L-1 NH4NO3溶液中含氮原子个数为NA | |
| C. | 过氧化氢分解制得1.12 L O2,转移电子数目为 0.2 NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$Xe+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为10NA |
10.把两片铂片插入200g10%CuSO4溶液中进行电解,当阳极析出0.16g气体时,CuSO4溶液的质量分数(消耗水的量忽略不计)是( )
| A. | 92.37% | B. | 9.2% | C. | 50% | D. | 25% |
14.一定条件下,在密闭容器中进行下列反应:
NO(g)+CO(g)═$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2kJ•mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
NO(g)+CO(g)═$\frac{1}{2}$N2(g)+CO2(g)△H=-373.2kJ•mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
| A. | 加催化剂同时升高温度 | B. | 降低温度同时增大压强 | ||
| C. | 充入CO | D. | 加催化剂同时增大压强 |
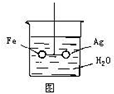 如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.
如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.