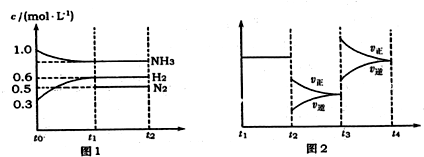
题目内容
17.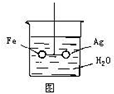 如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.
如图,在银圈和铁圈的联接处吊着一个绝缘的细丝,使之平衡,然后小心地从烧杯中央滴入CuSO4溶液.(1)片刻后可观察到的现象是银圈表面析出红色固体,银圈向下倾斜
(2)产生上述现象的原因是铁、银、硫酸铜构成原电池,铁不断失电子而减少,银上不断析出铜,质量增加,所以银圈逐渐向下倾斜.
分析 铁圈和银圈连接浸入硫酸铜溶液中,该装置构成了原电池,铁较活泼的金属作负极,银较不活泼的金属作正极,根据正负极上发生的电极反应判断反应现象.
解答 解:(1)依据金属活动顺序可知铁的活泼性强于银,铁圈和银圈的连接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液后,该装置构成了原电池,铁较活泼的金属作负极,失去电子,发生氧化反应生成铁离子,质量减小;银较不活泼的金属作正极,铜离子在正极得到电子发生还原反应生成铜,在银圈上析出,所以铁圈向上倾斜,银圈向下倾斜,
故答案为:银圈表面析出红色固体,银圈向下倾斜;
(2)产生上述现象的原因是:铁、银、硫酸铜构成原电池,铁不断失电子而减少,银上不断析出铜,质量增加,所以银圈逐渐向下倾斜;
故答案为:铁、银、硫酸铜构成原电池,铁不断失电子而减少,银上不断析出铜,质量增加,所以银圈逐渐向下倾斜.
点评 本题以铁的化学性质考查了原电池原理,为高频考点,题目难度不大,把握铁圈、银圈相连与原电池原理即可解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.用酸性氢氧燃料电池电解硫酸钠饱和溶液的装置如图所示 (a、b为铜电极).下列说法中不正确的是( )
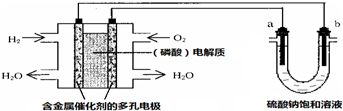

| A. | 电池工作时,正极反应式为:O2+4H++4e-═2H2O | |
| B. | 电解时,当阴极逸出amol气体,同时有W克Na2SO4﹒10H2O 析出,保持温度不变,剩余溶液中的硫酸钠的质量分数是$\frac{71W}{161(W+36a)}$×100% | |
| C. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| D. | 忽略能量损耗,当电池中消耗0.01g O2时,b 极周围会产生0.02g H2 |
 如图所示装置为在直流电的作用下电解200molNaCl溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源,通电一段时间后,B电极产生能使湿润的淀粉碘化钾试纸变蓝的气体224mL(标准状况),则:
如图所示装置为在直流电的作用下电解200molNaCl溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源,通电一段时间后,B电极产生能使湿润的淀粉碘化钾试纸变蓝的气体224mL(标准状况),则: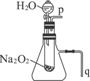 教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.
教材中有一个演示实验:用脱脂棉包住约0.2g Na2O2粉末,置于石棉网上,可观察到脱脂棉燃烧起来.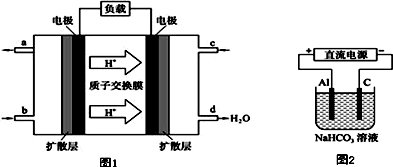
 (1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);