题目内容
10.把两片铂片插入200g10%CuSO4溶液中进行电解,当阳极析出0.16g气体时,CuSO4溶液的质量分数(消耗水的量忽略不计)是( )| A. | 92.37% | B. | 9.2% | C. | 50% | D. | 25% |
分析 m(CuSO4)=200g×10%=20g,用惰性电极电解硫酸铜溶液时,阳极反应式为4OH--4e-═2H2O+O2↑,阴极电极反应为Cu2++2e-=Cu,总反应离子方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+4H++O2↑,根据方程式知得硫酸铜参加反应的质量=$\frac{\frac{0.16g}{32g/mol}}{1}×2×160g/mol$=1.6g,还剩余硫酸铜质量=20g-1.6g=18.4g,根据质量分数公式计算电解后的溶液中硫酸铜质量分数.
解答 解:m(CuSO4)=200g×10%=20g,用惰性电极电解硫酸铜溶液时,阳极反应式为4OH--4e-═2H2O+O2↑,阴极电极反应为Cu2++2e-=Cu,总反应离子方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+4H++O2↑,根据方程式知得硫酸铜参加反应的质量=$\frac{\frac{0.16g}{32g/mol}}{1}×2×160g/mol$=1.6g,还剩余硫酸铜质量=20g-1.6g=18.4g,电解后溶液中硫酸铜质量分数=$\frac{18.4g}{200g}×100%$=9.2%,故选B.
点评 本题以电解原理为载体考查质量分数有关计算,为高频考点,明确析出氧气与硫酸铜的关系式是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如表:
请回答下列问题:
(1)C在元素周期表中位于第三周期、第IA族;D的基态原子核外电子排布式是1s22s22p63s23p4.
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同)S2->O2->Na+,B、D的简单氢化物中稳定性较大的是H2O.
(3)B的常见单质和C的单质按物质的量比1:2反应生成的化合物中化学键的类型为离子键、共价键;该化合物属于离子晶体.
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3.
(5)已知:2AB(g)+B2(g)═2AB2(g)△H=-566.0kJ•mol-1
D(s)+B2(g)═DB2(g)△H=-296.0kJ•mol-1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 元素的第一电离能是第3周期所有元素中最小的 |
| D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
(1)C在元素周期表中位于第三周期、第IA族;D的基态原子核外电子排布式是1s22s22p63s23p4.
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同)S2->O2->Na+,B、D的简单氢化物中稳定性较大的是H2O.
(3)B的常见单质和C的单质按物质的量比1:2反应生成的化合物中化学键的类型为离子键、共价键;该化合物属于离子晶体.
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是3Fe3O4+8Al$\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3.
(5)已知:2AB(g)+B2(g)═2AB2(g)△H=-566.0kJ•mol-1
D(s)+B2(g)═DB2(g)△H=-296.0kJ•mol-1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ•mol-1.
19.下列离子方程式书写正确的是( )
| A. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | 过量Ba(OH)2溶液与少量的NaHCO3溶液混合Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| C. | 石英溶于NaOH溶液:Si4++2O2-+2OH-=SiO32-+H2O | |
| D. | 硅酸钠溶液中滴加盐酸:SiO32-+2H+═H2SiO3↓ |
20.下列说法正确的是( )
| A. | 0.1mol/LCH3COOH溶液加水稀释,溶液中c(OH-)增大 | |
| B. | 将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的$\frac{1}{2}$ | |
| C. | 相同浓度的HCl和CH3COOH,两溶液中c(H+)相同 | |
| D. | 甲溶液的pH是5,乙溶液的pH是4,则甲溶液与乙溶液的中c(H+)之比为10:1 |

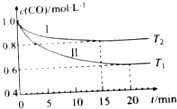 为了减少CO对大气的污染,某科研小组在一个体积为1L的容积不变的密闭容器中充入等量的CO和H2O(g),研究用CO和H2O(g)反应转化为绿色能源H2,不同温度下,CO的浓度[c(CO)]随时间[t]变化的曲线如图所示.
为了减少CO对大气的污染,某科研小组在一个体积为1L的容积不变的密闭容器中充入等量的CO和H2O(g),研究用CO和H2O(g)反应转化为绿色能源H2,不同温度下,CO的浓度[c(CO)]随时间[t]变化的曲线如图所示.
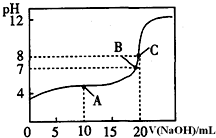 (1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);