题目内容
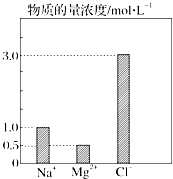 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.请回答下列问题:
(1)该混合液中,NaCl的物质的量为
(2)该混合液中CaCl2的物质的量为
考点:物质的量的相关计算,物质的量浓度的相关计算
专题:计算题
分析:由图象可知c(Na+)=1mol/L,c(Mg2+)=0.5 mol/L,c(Cl-)=3 mol/L,结合电荷守恒可知c(CaCl2),进而计算物质的量浓度.
解答:
解:由题图可知,n(Na+)=0.2 mol,n(Mg2+)=0.1 mol,n(Cl-)=0.6 mol,
(1)n(NaCl)=0.2 mol,n(MgCl2)=0.1 mol,m(MgCl2)=0.1 mol×95 g?mol-1=9.5 g,故答案为:0.2;9.5;
(2)CaCl2提供的n(Cl-)=0.6 mol-0.2 mol-0.1 mol×2=0.2 mol,则n(CaCl2)=0.1 mol,c(CaCl2)=
=0.1 mol?L-1,故答案为:0.1;0.1.
(1)n(NaCl)=0.2 mol,n(MgCl2)=0.1 mol,m(MgCl2)=0.1 mol×95 g?mol-1=9.5 g,故答案为:0.2;9.5;
(2)CaCl2提供的n(Cl-)=0.6 mol-0.2 mol-0.1 mol×2=0.2 mol,则n(CaCl2)=0.1 mol,c(CaCl2)=
| 0.1mol |
| 1L |
点评:本题考查物质的量的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用以及物质的构成特点,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2007年国家最高科学技术奖授予石油化工催化剂专家闵恩泽教授,以表彰他在催化剂研究方面做出的突出贡献.下列关于催化剂的说法正确的是( )
| A、使用催化剂可以增大正反应速率,减小逆反应速率 |
| B、使用催化剂可以使化学平衡向正反应方向移动 |
| C、使用催化剂可以降低反应的活化能 |
| D、使用催化剂可以改变反应的平衡常数 |
下列关于氧化还原反应的说法正确的是( )
| A、氧化还原反应中,发生氧化还原的一定是不同种元素 |
| B、氧化剂和还原剂一定是不同种物质 |
| C、还原剂失去电子总数一定等于氧化剂得到电子总数 |
| D、某氧化还原反应中,还原剂共失去4e-,氧化剂共得到4e-,所以该反应转移的电子总数为8e- |
下列说法中正确的是( )
| A、PCl3、NH3、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 |
| B、1mol SiO2 中含有2mol共价键 |
| C、NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
| D、原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度 |
下列物质中,属于离子化合物的是( )
| A、HNO3 |
| B、H2O2 |
| C、C2H4 |
| D、NaCl |