题目内容
(1)某厂废水中含KCN,其浓度为650mg?L-1现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O被氧化的元素是 .
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式,并标出电子转移方向和数目:
KOCN+ KOH+ Cl2→ CO2+ N2+ KCl+ H2O
(3)若将等浓度等体积的KCN与HCN混合,测得溶液中c(K+)>c(CN-),则该溶液的pH 7,原因是 ,要使c(K+)=c(CN-),应采取的措施是 .
(4)若将10m3含KCN的浓度为650mg?L-1的废水中KCN氧化除去,需要标准状况下的氯气的体积为 L.
(5)已知:Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=+234.1kJ?mol-1C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1则2Fe(s)+
O2(g)=Fe2O3(s)的△H是 .
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式,并标出电子转移方向和数目:
(3)若将等浓度等体积的KCN与HCN混合,测得溶液中c(K+)>c(CN-),则该溶液的pH
(4)若将10m3含KCN的浓度为650mg?L-1的废水中KCN氧化除去,需要标准状况下的氯气的体积为
(5)已知:Fe2O3(s)+
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
考点:氧化还原反应方程式的配平,用盖斯定律进行有关反应热的计算,盐类水解的原理
专题:
分析:(1)化合价升高的元素被氧化;
(2)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数;
(3)混合溶液中c(HCN)>c(CN-)说明HCN的电离程度小于CN-的水解程度,溶液呈碱性,溶液中存在物料守恒和电荷守恒;
(4)根据KCN和氯气的反应比例计算,再根据V=Vm×n计算即可;
(5)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减.
(2)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数;
(3)混合溶液中c(HCN)>c(CN-)说明HCN的电离程度小于CN-的水解程度,溶液呈碱性,溶液中存在物料守恒和电荷守恒;
(4)根据KCN和氯气的反应比例计算,再根据V=Vm×n计算即可;
(5)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减.
解答:
解:(1)反应中C元素化合价由KCN中+2价升高为KOCN中+4价,C元素被氧化,故答案为:碳(或C);
(2)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数,平衡后方程式为:2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O,
故答案为:2、4、3、2、1、6、2;
(3)混合溶液中c(K+)>c(CN-),说明HCN的电离程度小于CN-的水解程度,溶液呈碱性,则pH>7,根据电荷守恒c(K+)+c(H+)=c(CN-)+c(OH-),若加HCN调pH=7,则c(K+)=c(CN-);
故答案为:大于;因为CN-的水解大于HCN的电离;加HCN调pH=7即可使c(K+)=c(CN-);
(4)根据KCN+Cl2+2KOH═KOCN+2KCl+H20和2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O知KCN和氯气的反应的物质的量之比为1:2.5,10m3含KCN的浓度为650mg?L-1的废水中KCN物质的量=
=
=10mol,故氯气的物质的量为25mol,则标准状况下的氯气的体积V=25mol×22.4L/mol=5600L;
故答案为:5600;
(5)已知:Fe2O2(s)+
C(s)=
CO2(g)+2Fe(s)△H=234.1kJ?mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
由盖斯定律(2)×
-(1),得:2Fe(s)+
O2(g)=Fe2O3(s)△H=(-393.5kJ?mol-1)×
-234.1kJ?mol-1
即2Fe(s)+
O2(g)=Fe2O3(s)△H=-824.35kJ?mol-1.
故答案为:-824.4kJ?mol-1.
(2)反应中KOCN→N2,N元素化合价由-3价升高为0价,共升高6价,Cl2→KCl,Cl元素化合价由0价降低为-1价,共降低2价,化合价升降最小公倍数为6,故N2系数为1,Cl2系数为3,结合原子守恒配平其它物质的系数,平衡后方程式为:2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O,
故答案为:2、4、3、2、1、6、2;
(3)混合溶液中c(K+)>c(CN-),说明HCN的电离程度小于CN-的水解程度,溶液呈碱性,则pH>7,根据电荷守恒c(K+)+c(H+)=c(CN-)+c(OH-),若加HCN调pH=7,则c(K+)=c(CN-);
故答案为:大于;因为CN-的水解大于HCN的电离;加HCN调pH=7即可使c(K+)=c(CN-);
(4)根据KCN+Cl2+2KOH═KOCN+2KCl+H20和2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O知KCN和氯气的反应的物质的量之比为1:2.5,10m3含KCN的浓度为650mg?L-1的废水中KCN物质的量=
| m |
| M |
| 10×103L×650×10-3g/L |
| 65g/mol |
故答案为:5600;
(5)已知:Fe2O2(s)+
| 3 |
| 2 |
| 3 |
| 2 |
C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
由盖斯定律(2)×
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
即2Fe(s)+
| 3 |
| 2 |
故答案为:-824.4kJ?mol-1.
点评:本题考查了电解质溶液的酸碱性判断,氧化还原反应方程式的配平,电荷守恒、盖斯定律的应用,题目难度中等.

练习册系列答案
相关题目
已知某酸H2B在水溶液中存在下列关系:①H2B?H++HB-,②HB-?H++B2-.关于该酸对应的酸式盐NaHB的溶液,
下列说法中一定正确的是( )
下列说法中一定正确的是( )
| A、NaHB属于弱电解质 |
| B、溶液中的离子浓度c(Na+)>c(HB-)>c(H+)>c(OH-) |
| C、c(Na+)=c(HB-)+c(B2-)+c(H2B) |
| D、NaHB和NaOH溶液反应的离子方程式为H++OH-=H2O |
下列变化中,一定不存在化学能与热能相互转化的是( )
| A、酸碱中和反应 | B、白磷自燃 |
| C、燃放爆竹 | D、干冰气化 |
下列说法不正确的是( )
| A、磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等 |
| B、6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1 |
| C、32g氧气所含的原子数目为2×6.02×1023 |
| D、CO的摩尔质量与NA个CO分子质量相同 |
0.5mol O2中含有( )
| A、1个氧原子 |
| B、6.02×1023个氧分子 |
| C、1mol氧原子 |
| D、0.5个氧分子 |
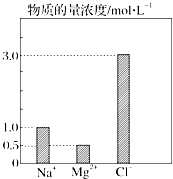 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.