题目内容
下列说法中正确的是( )
| A、PCl3、NH3、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 |
| B、1mol SiO2 中含有2mol共价键 |
| C、NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
| D、原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度 |
考点:离子晶体,原子核外电子排布,原子晶体
专题:
分析:A、依据原子结构可知氨气中的氢原子是2电子稳定结构,B原子最外层3个电子,和氟原子形成三个共价键,是6电子结构;
B、1mol SiO2 中含有1molSi,一个Si形成4个Si-O;
C、与每个Na+距离最近且相等的Na+分布在小立方体的面对角的位置,共有12个;
D、有些分子晶体中,分子内的原子以共价键相结合,如干冰,但分子晶体的熔沸点低、硬度小.
B、1mol SiO2 中含有1molSi,一个Si形成4个Si-O;
C、与每个Na+距离最近且相等的Na+分布在小立方体的面对角的位置,共有12个;
D、有些分子晶体中,分子内的原子以共价键相结合,如干冰,但分子晶体的熔沸点低、硬度小.
解答:
解:A、依据原子结构可知NH3中的氢原子是2电子稳定结构,B原子最外层3个电子,和氟原子形成三个共价键,是6电子结构,故A错误;
B、1mol SiO2 中含有1molSi,一个Si形成4个Si-O,因此1mol SiO2 中含有4mol共价键,故B错误;
C、与每个Na+距离最近且相等的Na+分布在小立方体的面对角的位置,共有12个,故C正确;
D、有些分子晶体中,分子内的原子以共价键相结合,如干冰,但分子晶体的熔沸点低,硬度小,故D错误;
故选C.
B、1mol SiO2 中含有1molSi,一个Si形成4个Si-O,因此1mol SiO2 中含有4mol共价键,故B错误;
C、与每个Na+距离最近且相等的Na+分布在小立方体的面对角的位置,共有12个,故C正确;
D、有些分子晶体中,分子内的原子以共价键相结合,如干冰,但分子晶体的熔沸点低,硬度小,故D错误;
故选C.
点评:本题考查了晶体的结构和性质,难度不大,注意有些分子晶体的分子内的原子以共价键相结合.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
往含有H+、Fe2+、Cu2+、Ag+四种离子的溶液中加入足量镁粉,最先得到的还原产物是( )
| A、H2 | B、Fe |
| C、Cu | D、Ag |
下列变化中,一定不存在化学能与热能相互转化的是( )
| A、酸碱中和反应 | B、白磷自燃 |
| C、燃放爆竹 | D、干冰气化 |
下列物质的分子中既有σ键又有π键的是( )
| A、HCl |
| B、Cl2 |
| C、C2H2 |
| D、CH4 |
下列说法不正确的是( )
| A、磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等 |
| B、6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1 |
| C、32g氧气所含的原子数目为2×6.02×1023 |
| D、CO的摩尔质量与NA个CO分子质量相同 |
NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
| A、常温常压下3.2 g O2中含有的氧原子数目为0.2 NA |
| B、101 kPa 0℃时,22.4 L氢气中含有NA个氢原子 |
| C、标准状况下,2.24 L 四氯化碳含有的碳原子数目为0.1NA |
| D、标准状况下,22.4LCl2和HCl的混合气体所含分子总数为2NA |
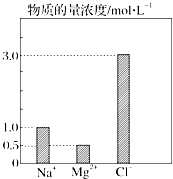 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.