题目内容
(1)用14.2g无水硫酸钠配制成500mL溶液,其物质的量浓度为 mol/L.
(2)若从中取出50mL,其物质的量浓度为 mol/L;溶质的质量为 g.
(3)若将这50mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为 mol/L,SO42-的物质的量浓度为 mol/L.
(2)若从中取出50mL,其物质的量浓度为
(3)若将这50mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为
考点:物质的量浓度的相关计算
专题:
分析:(1)根据n=
和C=
来计算;
(2)溶液是均一稳定的,取出一部分溶液后,溶液的浓度不变,根据n=CV和m=nM来计算;
(3)根据溶液稀释定律C浓V浓=C稀V稀来计算.
| m |
| M |
| n |
| V |
(2)溶液是均一稳定的,取出一部分溶液后,溶液的浓度不变,根据n=CV和m=nM来计算;
(3)根据溶液稀释定律C浓V浓=C稀V稀来计算.
解答:
解:(1)14.2g无水硫酸钠的物质的量n=
=
=0.1mol,溶液的浓度C=
=
=0.2mol/L,故答案为:0.2;
(2)溶液是均一稳定的,取出一部分溶液后,溶液的浓度不变,故取出50mL,其物质的量浓度为0.2mol/L;
物质的量n=CV=0.2mol/L×0.05L=0.01mol,溶质的质量m=nM=0.01mol×142g/mol=1.42g,
故答案为:0.2;1.42;
(3)溶液的浓度为0.2mol/L,故C(Na+)=0.4mol/L,C(SO42-)=0.2mol/L,
取50mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度变为原来的
,故Na+浓度变为0.2mol/L,SO42-浓度变为0.1mol/L,
故答案为:0.2,0.1;
| m |
| M |
| 14.2g |
| 142g/mol |
| n |
| V |
| 0.1mol |
| 0.5L |
(2)溶液是均一稳定的,取出一部分溶液后,溶液的浓度不变,故取出50mL,其物质的量浓度为0.2mol/L;
物质的量n=CV=0.2mol/L×0.05L=0.01mol,溶质的质量m=nM=0.01mol×142g/mol=1.42g,
故答案为:0.2;1.42;
(3)溶液的浓度为0.2mol/L,故C(Na+)=0.4mol/L,C(SO42-)=0.2mol/L,
取50mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度变为原来的
| 1 |
| 2 |
故答案为:0.2,0.1;
点评:本题考查了物质的量浓度的计算,把握住公式的使用是关键,难度不大.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等 |
| B、6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1 |
| C、32g氧气所含的原子数目为2×6.02×1023 |
| D、CO的摩尔质量与NA个CO分子质量相同 |
某温度下,向盐A的饱和溶液(质量分数为a%)中加入m克无水盐A,同温下析出n克A?xH2O晶体,则从饱和溶液中析出的溶质质量为(设A式量为M)( )
| A、n×a% | ||
| B、n-m | ||
C、
| ||
| D、(n-m)×a% |
NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
| A、常温常压下3.2 g O2中含有的氧原子数目为0.2 NA |
| B、101 kPa 0℃时,22.4 L氢气中含有NA个氢原子 |
| C、标准状况下,2.24 L 四氯化碳含有的碳原子数目为0.1NA |
| D、标准状况下,22.4LCl2和HCl的混合气体所含分子总数为2NA |
下列说法中正确的是(NA代表阿伏伽德罗常数)( )
| A、28g N2和28g CO所含的分子数都是NA |
| B、32g O3和32g O2所含的分子数都是NA |
| C、28g CO和44g CO2所含的氧原子数都是2NA |
| D、98g H2SO4和98g H3PO4所含的氧原子数都是4NA |
0.5mol O2中含有( )
| A、1个氧原子 |
| B、6.02×1023个氧分子 |
| C、1mol氧原子 |
| D、0.5个氧分子 |
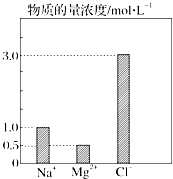 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示. 金属(M)的腐蚀是因为发生反应:M-ne-→Mn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁的腐蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属(M)的腐蚀是因为发生反应:M-ne-→Mn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁的腐蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.