题目内容
下列关于氧化还原反应的说法正确的是( )
| A、氧化还原反应中,发生氧化还原的一定是不同种元素 |
| B、氧化剂和还原剂一定是不同种物质 |
| C、还原剂失去电子总数一定等于氧化剂得到电子总数 |
| D、某氧化还原反应中,还原剂共失去4e-,氧化剂共得到4e-,所以该反应转移的电子总数为8e- |
考点:氧化还原反应
专题:
分析:A.发生氧化还原的可能为同种元素,也可能为不同元素;
B.氧化剂和还原剂可能为同种物质;
C.氧化还原反应中电子守恒;
D.失去电子数=得到电子数=转移电子总数.
B.氧化剂和还原剂可能为同种物质;
C.氧化还原反应中电子守恒;
D.失去电子数=得到电子数=转移电子总数.
解答:
解:A.发生氧化还原的可能为同种元素,如氯气与水的反应中只有Cl元素的化合价变化;也可能为不同元素,如氢气还原CuO中H、Cu元素的化合价变化,故A错误;
B.氧化剂和还原剂可能为同种物质,如氯气与水的反应中氯气为氧化剂,也是还原剂,故B错误;
C.氧化还原反应中电子守恒,则还原剂失去电子总数一定等于氧化剂得到电子总数,故C正确;
D.失去电子数=得到电子数=转移电子总数,所以还原剂共失去4e-,氧化剂共得到4e-,所以该反应转移的电子总数为4e-,故D错误;
故选C.
B.氧化剂和还原剂可能为同种物质,如氯气与水的反应中氯气为氧化剂,也是还原剂,故B错误;
C.氧化还原反应中电子守恒,则还原剂失去电子总数一定等于氧化剂得到电子总数,故C正确;
D.失去电子数=得到电子数=转移电子总数,所以还原剂共失去4e-,氧化剂共得到4e-,所以该反应转移的电子总数为4e-,故D错误;
故选C.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念及转移电子的考查,选项D为解答的难点,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
一定条件下,体积为2L的密闭容器中,1mol X和3mol Y进行反应:X(g)+3Y(g)?2Z(g),经12s达到平衡,生成0.6mol Z.下列说法正确的是( )
| A、以X浓度变化表示的反应速率为0.25 mol?L-1?s-1 |
| B、12 s后将容器体积扩大为10 L,Z的平衡浓度变为原来的1/5 |
| C、若增大X的浓度,则物质Y的转化率减小 |
| D、若该反应的△H<0,升高温度,平衡常数K减小 |
 如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得两个装置中均通过0.02mol电子时(不考虑盐的水解和溶液体积的变化)则下列叙述中正确的是( )
如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得两个装置中均通过0.02mol电子时(不考虑盐的水解和溶液体积的变化)则下列叙述中正确的是( )| A、电极上析出物质的质量:①=② |
| B、溶液的pH变化:①增大,②不变 |
| C、电极反应式:①中阳极 2Cl--2e-═Cl2↑ ②中负极 2H++2e-═H2↑ |
| D、产生气体的体积:①=② |
某盐溶液中含有K+、Zn2+、Cl-、SO42-四种离子,若n(K+)为0.2mol,n(Zn2+)为0.4mol,n(Cl-)为0.4mol,则SO42-的物质的量为( )
| A、0.3mol |
| B、0.5mol |
| C、0.15mol |
| D、0.2mol |
某温度下,向盐A的饱和溶液(质量分数为a%)中加入m克无水盐A,同温下析出n克A?xH2O晶体,则从饱和溶液中析出的溶质质量为(设A式量为M)( )
| A、n×a% | ||
| B、n-m | ||
C、
| ||
| D、(n-m)×a% |
由14CO和12CO组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列说法正确的是( )
| A、混合气体中14CO和12CO的分子数之比为2:1 |
| B、混合气体中12CO占有的体积大于14CO占有的体积 |
| C、混合气体中14CO和12CO的质量之比为14:15 |
| D、混合气体中14CO和12CO的密度之比为15:14 |
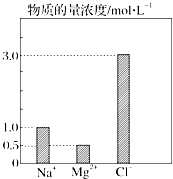 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.