题目内容
下列物质中,属于离子化合物的是( )
| A、HNO3 |
| B、H2O2 |
| C、C2H4 |
| D、NaCl |
考点:离子化合物的结构特征与性质
专题:化学键与晶体结构
分析:一般来说,活泼金属和活泼元素之间易形成离子键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,金属氧化物、大多数盐、铵盐中都含有离子键,据此分析解答.
解答:
解:A.硝酸分子中只含共价键,属于共价化合物,故A错误;
B.双氧水分子中只含共价键,属于共价化合物,故B错误;
C.乙烯分子中只含共价键,属于共价化合物,故C错误;
D.NaCl中钠离子和氯离子之间只存在离子键,属于离子化合物,故D正确;
故选D.
B.双氧水分子中只含共价键,属于共价化合物,故B错误;
C.乙烯分子中只含共价键,属于共价化合物,故C错误;
D.NaCl中钠离子和氯离子之间只存在离子键,属于离子化合物,故D正确;
故选D.
点评:本题考查离子化合物的判断,根据物质的构成微粒确定化学键,知道离子键和化合键的区别,题目难度不大.

练习册系列答案
相关题目
强酸与强碱的稀溶液发生中和反应的热化学方程式为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓H2SO4;③稀硝酸.恰好完全反应时的热效应分别为△H1、△H2、△H3,它们的关系正确的是( )
| A、△H1>△H2>△H3 |
| B、△H2>△H3>△H1 |
| C、△H1=△H2=△H3 |
| D、△H1>△H3>△H2 |
某盐溶液中含有K+、Zn2+、Cl-、SO42-四种离子,若n(K+)为0.2mol,n(Zn2+)为0.4mol,n(Cl-)为0.4mol,则SO42-的物质的量为( )
| A、0.3mol |
| B、0.5mol |
| C、0.15mol |
| D、0.2mol |
下列说法不正确的是( )
| A、磷酸的摩尔质量与6.02×1023个磷酸分子的质量在数值上相等 |
| B、6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14:1 |
| C、32g氧气所含的原子数目为2×6.02×1023 |
| D、CO的摩尔质量与NA个CO分子质量相同 |
某温度下,向盐A的饱和溶液(质量分数为a%)中加入m克无水盐A,同温下析出n克A?xH2O晶体,则从饱和溶液中析出的溶质质量为(设A式量为M)( )
| A、n×a% | ||
| B、n-m | ||
C、
| ||
| D、(n-m)×a% |
下列说法中正确的是(NA代表阿伏伽德罗常数)( )
| A、28g N2和28g CO所含的分子数都是NA |
| B、32g O3和32g O2所含的分子数都是NA |
| C、28g CO和44g CO2所含的氧原子数都是2NA |
| D、98g H2SO4和98g H3PO4所含的氧原子数都是4NA |
常温下,浓度均为0.1mol/L的4种溶液pH如表:下列说法正确的是( )
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 4.0 |
| A、向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度 |
| B、四种溶液中,水的电离程度最大的是NaClO |
| C、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3 |
| D、NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) |
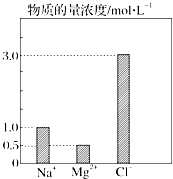 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.