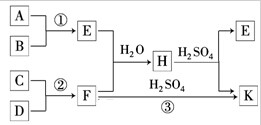
题目内容
有一组成为Ca3(PO4)2?4H3PO4?3H2O的盐,写出分别以酸式盐和氧化物形式表示其组成的式子:
(1)酸式盐形式 .
(2)氧化物形式 .
(1)酸式盐形式
(2)氧化物形式
考点:酸、碱、盐、氧化物的概念及其相互联系
专题:物质的分类专题
分析:(1)根据钙元素和磷元素的原子个数比来确定;
(2)根据盐表示为氧化物的顺序是:活泼金属氧化物?不活泼金属氧化物?非金属氧化物?水.
(2)根据盐表示为氧化物的顺序是:活泼金属氧化物?不活泼金属氧化物?非金属氧化物?水.
解答:
解:(1)在此盐中,钙元素和磷元素的原子个数比为1:2,故表示为酸式盐的形式的话,是磷酸二氢盐,即Ca(H2PO4)2?H2O,故答案为:Ca(H2PO4)2?H2O;
(2)盐表示为氧化物的顺序是:活泼金属氧化物?不活泼金属氧化物?非金属氧化物?水.故Ca3(PO4)2?4H3PO4?3H2O的盐表示为氧化物的形式是CaO?P2O5?3H2O,故答案为:CaO?P2O5?3H2O.
(2)盐表示为氧化物的顺序是:活泼金属氧化物?不活泼金属氧化物?非金属氧化物?水.故Ca3(PO4)2?4H3PO4?3H2O的盐表示为氧化物的形式是CaO?P2O5?3H2O,故答案为:CaO?P2O5?3H2O.
点评:本题考查了盐的表示形式,掌握方法是关键,难度不大.

练习册系列答案
相关题目
下列说法中正确的是(NA代表阿伏伽德罗常数)( )
| A、28g N2和28g CO所含的分子数都是NA |
| B、32g O3和32g O2所含的分子数都是NA |
| C、28g CO和44g CO2所含的氧原子数都是2NA |
| D、98g H2SO4和98g H3PO4所含的氧原子数都是4NA |
0.5mol O2中含有( )
| A、1个氧原子 |
| B、6.02×1023个氧分子 |
| C、1mol氧原子 |
| D、0.5个氧分子 |
由14CO和12CO组成的混合气体与同温、同压下空气(平均相对分子质量为29)的密度相同,则下列说法正确的是( )
| A、混合气体中14CO和12CO的分子数之比为2:1 |
| B、混合气体中12CO占有的体积大于14CO占有的体积 |
| C、混合气体中14CO和12CO的质量之比为14:15 |
| D、混合气体中14CO和12CO的密度之比为15:14 |
常温下,浓度均为0.1mol/L的4种溶液pH如表:下列说法正确的是( )
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 4.0 |
| A、向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度 |
| B、四种溶液中,水的电离程度最大的是NaClO |
| C、常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3 |
| D、NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-) |
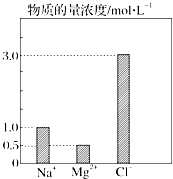 在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示.
在0.2L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示. 金属(M)的腐蚀是因为发生反应:M-ne-→Mn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁的腐蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.
金属(M)的腐蚀是因为发生反应:M-ne-→Mn+.金属腐蚀造成很大的经济损失,甚至超过自然灾害,其中钢铁的腐蚀最为严重,寻求防止钢铁腐蚀的方法意义重大.