题目内容
17.甲醇是新型的汽车动力燃料.工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g)?CH3OH(g)△H1=-116kJ•mol-1(1)已知:CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=-283kJ•mol-1H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H3=-242kJ•mol-1 1mol甲醇气体完全燃烧生成CO2和水蒸气的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1.
(2)下列措施中有利于提高2H2(g)+CO(g)?CH3OH(g)反应速率的是BD(双选).
A.分离出CH3OH B.升高温度 C.减小压强 D.加入合适的催化剂
(3)用H2和CO化合制备甲醇的反应中,若反应的容积为1L的恒容容器,分别在230℃、250℃和270℃下,改变H2和CO的起始组成比(起始时CO的物质的量固定为1mol)进行实验,结果如图所示(图中曲线上的点都为一定温度下、一定组成下的平衡点):
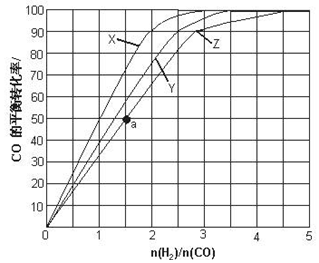
①曲线X对应的温度是230℃.
②从图中可以得出的结论有温度越高,CO的转化率越低或n(H2):n(CO)越低,CO的转化率越大.(写一条)
(4)若往反应的容积中加入1.5molH2HE 1.0moCO,在曲线Z对应温度下反应达平衡.利用上述图中a点对应的CO平衡转化率,计算2H2(g)+CO(g)?CH3OH (g)的平衡常数(写出计算过程).
分析 (1)根据反应①CO(g)+2H2(g)?CH3OH(g);△H1=-116kJ•mol-1,
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-242kJ•mol-1,
根据盖斯定律:②+③×2-①得到所需热化学方程式和焓变;
(2)提高反应速率可增大浓度、压强、温度或加入催化剂;
(3)①正反应放热,则升高温度CO的转化率降低;
②由图可知,温度越高,CO的转化率越低,CO和 H2的起始组成比越小,CO的转化率越大;
(4)计算出平衡时各物质的浓度,结合K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$计算.
解答 解:(1)根据反应①CO(g)+2H2(g)?CH3OH(g);△H1=-116kJ•mol-1,
②CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H2=-283kJ•mol-1,
③H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H3=-242kJ•mol-1,
根据盖斯定律:②+③×2-①得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1,
故答案是:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(g)△H=-651kJ•mol-1;
(2)提高反应速率可增大浓度、压强、温度或加入催化剂,则B、D正确,而移去部分CH3OH、减小压强可减小反应速率,故答案为:BD;
(3)①根据该反应为放热反应,温度越高CO的转化率越小,所以曲线X为230℃,故答案为:230℃;
②由图可知,温度越高,CO的转化率越低,CO和 H2的起始组成比越小,CO的转化率越大,
故答案为:温度越高,CO的转化率越低或n(H2):n(CO)越低,CO的转化率越大;
(4)由图象可知a点对应CO的转化率为50%,n(H2):n(CO)=1.5,则
CO(g)+2H2(g)?CH3OH (g)
起始(mol/L) 1 1.5 0
转化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 0.5 0.5
K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×0.{5}^{2}}$=4.00,
答:2H2(g)+CO(g)?CH3OH (g)的平衡常数为4.00.
点评 本题考查化学平衡问题,侧重于学生的分析和计算能力的考查,为高考常见题型和高频考点,注意把握图象曲线的变化趋势,把握平衡常数的计算方法,题目难度中等.

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2?2NH3 该可逆反应达到平衡的标志是BCE.
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间而变化
E.a mol N≡N键断裂的同时,有6a mol N-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
(2)某化学研究性学习小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如表:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
该温度下平衡常数K=2.37.
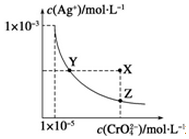 在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10-13,下列说法错误的是( )
在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10-13,下列说法错误的是( )| A. | t℃时,Ag2CrO4的Ksp为1×10-8 | |
| B. | 在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 | |
| C. | 一定温度下Y点和Z点时Ag2CrO4的Ksp相等 | |
| D. | 在t℃时,Ag2CrO4(s)+2Br-(aq)?2AgBr(s)+CrO42-(aq)平衡常数K=4.0×1010 |
| A. | NH3的电子式: | |
| B. | CS2分子的球棍模型: | |
| C. | 二氧化硅的分子式:SiO2 | |
| D. | Mg5(Si4O10)2(OH)2•4H2O的氧化物形式:5MgO•8SiO2•5H2O |
| A. | X的气态氢化物的热稳定性比O(氧)的强 | |
| B. | 元素Z、W的简单离子具有相同的电子层结构 | |
| C. | Y、Z、W的最高价氧化物对应的水化物之间能相互反应 | |
| D. | 等质量的Y和Z单质分别与足量稀盐酸反应,前者产生的氢气多 |
 2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )
2016年8月10日《生物谷》载文称,“毒性气体”CO、NO及H2S可作为新型药物开发的潜在靶点,用以开发更多新型药物来帮助治疗多种人类疾病.下列有关这三种气体的说法正确的是( )| A. | 都是电解质 | B. | 都易溶于水 | ||
| C. | 都能与碱溶液反应 | D. | 都属于共价化合物 |
 图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色.请填写下列空白:
图示中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物,它们的焰色反应均为黄色.请填写下列空白: 酸碱中和在化工生产中有着重要应用.
酸碱中和在化工生产中有着重要应用.