题目内容
8.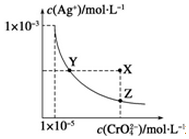 在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10-13,下列说法错误的是( )
在t℃时,Ag2CrO4(橘红色)在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgBr的Ksp=5.0×10-13,下列说法错误的是( )| A. | t℃时,Ag2CrO4的Ksp为1×10-8 | |
| B. | 在饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点 | |
| C. | 一定温度下Y点和Z点时Ag2CrO4的Ksp相等 | |
| D. | 在t℃时,Ag2CrO4(s)+2Br-(aq)?2AgBr(s)+CrO42-(aq)平衡常数K=4.0×1010 |
分析 A.Ksp(Ag2CrO4)=c(CrO42-)c2(Ag+);
B.饱和Ag2CrO4溶液中加入K2CrO4,c(CrO42-)增大,平衡逆向移动;
C.沉淀溶解平衡曲线上的点均为平衡点,Ksp只与温度有关;
D.在t℃时,Ag2CrO4(s)+2Br-(aq)?2AgBr(s)+CrO42-(aq)平衡常数K=$\frac{c(Cr{{O}_{4}}^{2-})}{{c}^{2}(B{r}^{-})}$=$\frac{Ksp(A{g}_{2}Cr{O}_{4})}{Ks{p}^{2}(AgBr)}$.
解答 解:A.Ksp(Ag2CrO4)=c(CrO42-)c2(Ag+)=(1×10-5)×(1×10-3)2=1×10-11,故A错误;
B.饱和Ag2CrO4溶液中加入K2CrO4,c(CrO42-)增大,平衡逆向移动,则c(Ag+)减小,而Y点变为X点c(Ag+)不变,不能使溶液由Y点变为X点,故B正确;
C.沉淀溶解平衡曲线上的点均为平衡点,Ksp只与温度有关,则一定温度下Y点和Z点时Ag2CrO4的Ksp相等,故C正确;
D.在t℃时,Ag2CrO4(s)+2Br-(aq)?2AgBr(s)+CrO42-(aq)平衡常数K=$\frac{c(Cr{{O}_{4}}^{2-})}{{c}^{2}(B{r}^{-})}$=$\frac{Ksp(A{g}_{2}Cr{O}_{4})}{Ks{p}^{2}(AgBr)}$=$\frac{1×1{0}^{-11}}{(5×1{0}^{-13})^{2}}$=4.0×1013,故D错误;
故选AD.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp的计算、溶解平衡图象、平衡移动为解答的关键,侧重分析与应用能力的考查,选项D为解答的难点,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
| A. | 过滤操作中,玻璃棒应适时搅拌漏斗器 | |
| B. | 蒸发时,不能把蒸发皿放置于石棉网上加热 | |
| C. | 萃取分液时,将塞上凹槽或小孔对准漏斗上小孔,然后打开活塞才能放出下层液体 | |
| D. | 配制容量瓶,定容时改用胶头滴管滴加蒸馏水 |
| A. | 试管 | B. | 蒸发皿 | C. | 坩埚 | D. | 烧杯 |
Zn(s)+$\frac{1}{2}$O2(g)═ZnO(s)△H=-351.1kJ•mol-1
2Hg(l)+O2(g)═2HgO(s)△H=-181.4kJ•mol-1
由此可知Zn(s)+HgO(s)═ZnO(s)+Hg(l)△H=____( )
| A. | -441.8kJ•mol-1 | B. | -254.8kJ•mol-1 | C. | -438.9kJ•mol-1 | D. | -260.4kJ•mol-1 |

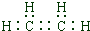 .
.