题目内容
7.氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料.(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2?2NH3 该可逆反应达到平衡的标志是BCE.
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间而变化
E.a mol N≡N键断裂的同时,有6a mol N-H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
(2)某化学研究性学习小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如表:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
该温度下平衡常数K=2.37.
分析 (1)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,由此衍生的一些物理性不变,以此解答该题;
(2)同一温度下,容器中气体压强与总的物质的量成正比,根据压强计算平衡时混合气体的物质的量,再根据v=$\frac{△c}{△t}$计算氮气的平均反应速率;根据平衡时各物质的浓度计算其平衡常数.
解答 解:(1)A.2v(H2)正=3v(NH3)逆时,该反应达到平衡状态,所以3v(H2)正=2v(NH3)逆时该反应没有达到平衡状态,故错误;
B.单位时间生成m mol N2的同时消耗3m mol H2,正逆反应速率相等,所以该反应达到平衡状态,故正确;
C.对反应前后气体体积不相等反应,容器内的总压强不再随时间而变化,反应体系中各物质的浓度不变,所以达到平衡状态,故正确;
D.无论该反应是否达到平衡状态,混合气体的密度不随时间变化,所以密度不能作为判断依据,故错误;
E.a molN≡N键断裂的同时,有6amolN-H键断裂,正逆反应速率相等,所以该反应达到平衡状态,故正确;
F.N2、H2、NH3的分子数之比为1:3:2时该反应不一定达到平衡状态,与反应物的初始浓度及转化率有关,故错误;
故选:BCE;
(2)同一温度下,容器中气体压强与总的物质的量成正比,设平衡状态时混合气体的物质的量为x,
16.80:12.60=(1+3)mol:x,x=$\frac{4mol×12.60}{16.80}$=3mol,所以平衡时混合气体的物质的量为3mol,
设参加反应的氮气的物质的量为y,
N2(g)+3H2(g)?2NH3(g)物质的量减少
1mol 2mol
y (4-3)mol
1mol:2mol=y:(4-3)mol,
y=$\frac{1mol×(4-3)mol}{2mol}$=0.5mol,
则从反应开始到25min时,以N2表示的平均反应速率=$\frac{\frac{0.5mol}{2L}}{25min}$=0.01mol/(L•min),
平衡时,c(N2)=$\frac{0.5mol}{2L}$=0.25mol/L、c(H2)=$\frac{3mol-3×0.5mol}{2L}$=0.75mol/L、c(NH3)=$\frac{0.5mol×2}{2L}$=0.5mol/L,化学平衡常数K=$\frac{0.5×0.5}{0.25×(0.75){{\;}^{3}}^{\;}}$=2.37,
故答案为:0.01 mol/(L•min);2.37.
点评 本题考查较综合,涉及化学平衡计算、平衡判断,侧重考查知识运用能力,注意掌握化学平衡状态的判断方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案请根据如图1示意图回答(1)、(2)有关问题:
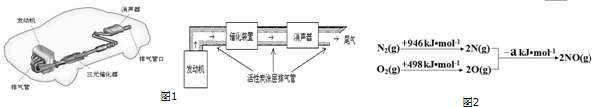
(1)汽车发动机工作时会引发N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1,其能量变化示意图如图2:
则NO中氮氧键的键能为632 kJ•mol-1.
(2)利用活性炭涂层排气管处理NOx的反应为:xC(s)+2NOx(g)?N2(g)+xCO2 (g)△H=-b kJ•mol-1.若使NOx更加有效的转化为无毒尾气排放,以下措施理论上可行的是AD.
A.增加排气管长度 B.增大尾气排放口 C.升高排气管温度 D.添加合适的催化剂
(3)工业上一般采用下列两种反应合成甲醇:
反应a:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.5kJ•mol-1
反应b:CO (g)+2H2(g)?CH3OH(g)△H=-91.8kJ•mol-1
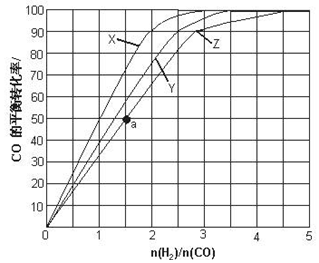
①对于反应a,某温度下,将4.0mol CO2(g)和12.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,测得甲醇蒸气的体积分数为30%,则该温度下反应的平衡常数为1.33;
②对于反应b,在763K、3.04×104kPa时,用CO和H2做原料合成CH3OH,当原料中CO和H2的比例不同时,对CO的转化率及平衡混合物中甲醇的体积分数都有影响.设H2和CO起始物质的量之比为m,平衡时CO的转化率为α,平衡混合物中甲醇的体积分数为y,则m、α、y三者的关系式为y=$\frac{α}{1+m+2a}$
(i)请根据上述关系式将如表空白填满:
| m | α | y |
| 1 | 0.25 | 16.67% |
| 2 | 0.45 | |
| 3 | 0.56 | 19.35% |
(4)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:
CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H<0
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态.当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是D;
A.逆反应速率先增大后减小
B.通入一定量的He,体系压强增大
C.正反应速率先减小后增大
D.化学平衡常数K值增大
②已知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量.关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是AC(填字母)
A.两种燃料互为同分异构体,分子式和摩尔质量相同,但比能量不相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
③已知甲醇的热值是23kJ•g-1,请写出表示甲醇燃烧热的热化学方程式CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-736kJ/mol.
| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若温度不变,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n |
 已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题:

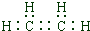 .
.
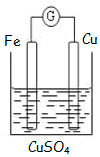 如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.