题目内容
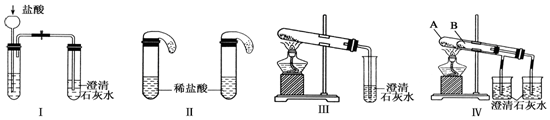
7.某化学兴趣小组选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题.
(1)A中制取乙炔的化学方程式为CaC2+2H2O→C2H2↑+Ca(OH)2.
(2)制乙炔时,旋开分液漏斗的活塞,使水慢慢滴下的原因是控制反应速率,使产生的气流稳定,避免产生的泡沫进入导管
(3)用电石制得的乙炔中常含有H2S、PH3等杂质,除去杂质应选用C(填序号,下同)装置,干燥乙炔最好选用D装置
(4)为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:
纯净乙炔气$→_{催化剂}^{HBr}$混合液$\stackrel{操作a}{→}$有机混合物Ⅰ$→_{△}^{NaOH溶液}$混合液$\stackrel{操作b}{→}$有机混合物Ⅱ
①操作b的名称是蒸馏或分馏;
②有机混合物Ⅰ可能含有的物质是CH2═CHBr、CH3-CHBr2、CH2Br-CH2Br(写结构简式)
分析 A用于制备乙炔,乙炔中含有H2S、PH3等杂质,可用硫酸铜溶液除去,然后用碱石灰干燥,
(1)制取乙炔使用电石(碳化钙)和水反应;
(2)由于CaC2与H2O反应剧烈,产生C2H2的速率很快,故应控制H2O的滴速来达到控制反应速率,防止产生的泡沫进入导气管;
(3)根据乙炔制取实验分析;
(4)CH≡CH与HBr发生加成反应时,若CH≡CH中断裂一个键,则与HBr加成可得CH2═CHBr,CH2═CHBr能继续与HBr加成得到CH3-CHBr2、BrCH2-CH2Br.分离有机物一般是根据其沸点差异进行分离.有机反应有副产物.
解答 解:(1)制取乙炔使用电石(碳化钙)和水反应生产乙炔和氢氧化钙:CaC2+2H2O→C2H2↑+Ca(OH)2,故答案为:CaC2+2H2O→C2H2↑+Ca(OH)2;
(2)由于CaC2与H2O反应剧烈,产生C2H2的速率很快,故应控制H2O的滴速来达到控制反应速率,防止产生的泡沫进入导气管,
故答案为:控制反应速率,使产生的气流稳定,避免产生的泡沫进入导管.
(3)H2S、PH3等杂质均能被CuSO4溶液吸收,硫化氢和硫酸铜反应生成CuS沉淀,PH3易溶于水.碱石灰是NaOH、CaO的混合物,其干燥效率优于CaCl2,故用D装置干燥C2H2,
故答案为:C;D;
(4)CH≡CH与HBr发生加成反应时,若CH≡CH中断裂一个键,则与HBr加成可得CH2═CHBr,CH2═CHBr能继续与HBr加成得到CH3-CHBr2、BrCH2-CH2Br.分离有机物一般是根据其沸点差异,采用蒸馏或分馏方法,
故答案为:①蒸馏或分馏;②CH2═CHBr、CH3-CHBr2、CH2Br-CH2Br.
点评 本题考查有机物的制备和性质实验,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的操作,难度不大.

| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热反应(填“吸热”、“放热”),写出该反应的平衡常数表达式:K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是bc.
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)能判断该反应是否达到化学平衡状态的依据是bc.
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为b,CO2的物质的量为c.
a.等于1.0mol b.大于1.0mol
c.大于0.5mol,小于1.0mol d.无法确定.
 一定条件下,在容积为3L的密闭容器中,发生反应CO(g)+2H2(g)?CH3OH(g)△H<0,在不同温度下甲醇的物质的量随时间的变化如图所示.下列叙述正确的是( )
一定条件下,在容积为3L的密闭容器中,发生反应CO(g)+2H2(g)?CH3OH(g)△H<0,在不同温度下甲醇的物质的量随时间的变化如图所示.下列叙述正确的是( )| A. | 平衡常数K(300℃)<K(500℃) | |
| B. | 500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=$\frac{nB}{3tB}$ mol•L-1•min-1 | |
| C. | 在其他条件不变的情况下,将处于E点的体系的容积压缩到原来的$\frac{1}{2}$,氢气的浓度减小 | |
| D. | 300℃,当容器内压强不变时说明反应已经达到平衡 |
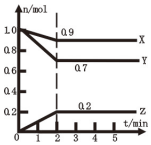 (1)某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.
(1)某温度时,在2L容器中X、Y、Z三种气体物质的物质的量(n)随着时间(t)变化的曲线如图所示.
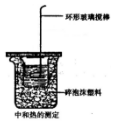 某同学用如图装置做中和热的测定实验
某同学用如图装置做中和热的测定实验