��Ŀ����
1��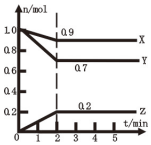 ��1��ij�¶�ʱ����2L������X��Y��Z�����������ʵ����ʵ�����n������ʱ�䣨t���仯��������ͼ��ʾ��
��1��ij�¶�ʱ����2L������X��Y��Z�����������ʵ����ʵ�����n������ʱ�䣨t���仯��������ͼ��ʾ���ٸ÷�Ӧ�Ļ�ѧ����ʽΪ��X+3Y?2Z
�ڷ�Ӧ��ʼ��2min����Z��ʾ��ƽ����Ӧ����Ϊ0.05mol•��L•min��-1
��2����Ӧ3Fe��s��+4H2O��g��?Fe3O4��s��+4H2��g������һ�ݻ��ɱ���ܱ������н��У��Իش�
������Fe������������Ӧ���ʲ��䣨����������䡱������С��������ͬ����ƽ�ⲻ�ƶ��ƶ������������������Ӧ���������淴Ӧ����������ͬ����
�ڽ������������Сһ�룬������Ӧ��������ƽ�ⲻ�ƶ���
�۱���������䣬����N2ʹ��ϵѹǿ����������Ӧ���ʲ��䣬ƽ�ⲻ�ƶ���
�ܱ���������䣬����ˮ������������Ӧ��������ƽ��������Ӧ�����ƶ���
���� ��1���ٸ������ʵ����ı仯�жϷ�Ӧ���������������ʵ����ı仯֮�ȵ��ڻ�ѧ������֮����д����ʽ��
�ڸ���v=$\frac{��c}{��t}$���㷴Ӧ���ʣ�
��2�������ǹ��壬���������������ܸı䷴Ӧ���ʣ�Ҳ���ܸı仯ѧƽ�⣻
�������������С�������ڸ����ʵ�Ũ�ȶ�����ѧ��Ӧ����Խ�죻
��������䣬����N2ʹ��ϵѹǿ���������ʵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���
�ܱ���������䣬����ˮ����������Ӧ��������ƽ��������Ӧ�����ƶ���
��� �⣺��1������ͼ����Կ�������Ӧ��X��Y�����ʵ�����С��Z�����ʵ������࣬��X��YΪ��Ӧ�ZΪ�����
�ҡ�n��X������n��Y������n��Z��=0.1mol��0.3mol��0.2mol=1��3��2����Ӧ�Ļ�ѧ����ʽΪ��X+3Y?2Z��
�ʴ�Ϊ��X+3Y?2Z��
��v��Z��=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol•��L•min��-1���ʴ�Ϊ��0.05mol•��L•min��-1��
��2���������ǹ��壬������������û����������Ũ�ȣ����Բ��ܸı䷴Ӧ���ʣ�Ҳ���ܸı仯ѧƽ�⣬�ʴ�Ϊ�����䣻����
�������������С�������ڸ����ʵ�Ũ�ȶ�����Ũ��Խ��ѧ��Ӧ����Խ�죬��Ӧ3Fe��s��+4H2O��g��?Fe3O4��s��+4H2��g����ƽ�ⲻ�ƶ����ʴ�Ϊ��������
��������䣬����N2ʹ��ϵѹǿ���������ʵ�Ũ�Ȳ��䣬���Է�Ӧ���ʲ��䣬ƽ�ⲻ�ƶ����ʴ�Ϊ�����䣻����
�ܱ���������䣬����ˮ������H2O��g���������Ӧ��������ƽ��������Ӧ�����ƶ����ʴ�Ϊ������������Ӧ����
���� ���⿼�黯ѧ��Ӧ���ʵļ��㼰�뻯ѧ������֮��Ĺ�ϵ����ѧ��Ӧ���ʺͻ�ѧƽ���Ӱ�����أ�����ʱӦע�⣺��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�����÷�Χ����Һ�����壻��ѹǿ�Ի�ѧ��Ӧ���ʵ�Ӱ����ͨ���ı����ʵ�Ũ��Ӱ��ģ����¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ�����������л�ѧ��Ӧ�����۸÷�Ӧ�Ƿ��ȷ�Ӧ�������ȷ�Ӧ��

| A�� |  3-��-2-�һ����� 3-��-2-�һ����� | |
| B�� | ��CH3��3CCH2CH��C2H5��CH3 2��2-����-4-�һ����� | |
| C�� | 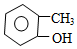 �ڼ����� �ڼ����� | |
| D�� |  2-��-3-��Ȳ 2-��-3-��Ȳ |
 ��֪ij���淴Ӧ���ܱ������н��У�A��g��+2B��g��?3C��g��+D��s�������ȷ�Ӧ����ͼ������b����һ�������¸÷�Ӧ�Ĺ��̣���ʹ����b��Ϊ����a���ɲ�ȡ�Ĵ�ʩ�ǣ�������
��֪ij���淴Ӧ���ܱ������н��У�A��g��+2B��g��?3C��g��+D��s�������ȷ�Ӧ����ͼ������b����һ�������¸÷�Ӧ�Ĺ��̣���ʹ����b��Ϊ����a���ɲ�ȡ�Ĵ�ʩ�ǣ�������| A�� | ����A��Ũ�� | B�� | ����C��Ũ�� | C�� | ������� | D�� | �����¶� |
| A�� | ����ʱ������Ҫ���ϸɾ��ij���ֽ | |
| B�� | ��Һʱ�����в���Һ�彦���������������ҺŨ��ƫС | |
| C�� | ����ʱ��������ƿ�̶��ߣ������������ҺŨ��ƫ�� | |
| D�� | ����ҡ�Ⱥ���Һ���½�����Ӧ�ټ�����ˮ |
| A�� | 3p�������2��δ�ɶԵ��ӵ�ԭ�Ӻ�4p�������2��δ�ɶԵ��ӵ�ԭ�� | |
| B�� | 3p�����ֻ��1���չ����ԭ�Ӻ�4p�����ֻ��1���չ����ԭ�� | |
| C�� | ���������Ų�Ϊ1s2��ԭ�Ӻ����������Ų�Ϊ2s2��ԭ�� | |
| D�� | ���������Ų�Ϊ3s2��ԭ�Ӻ����������Ų�Ϊ4s2��ԭ�� |
���Ƽ�ѭ����������
��1���˷�������Na2SO3��Һ���ѳ������е�SO2��Na2SO3����NaOH��Һ����SO2�Ƶã��÷�Ӧ�����ӷ���ʽ��2OH-+SO2�TSO32-+H2O��
��2��NaOH��Һ����SO2�Ĺ����У�pH��n��SO32-����n��HSO3-���仯��ϵ�����
| n��SO32-����n��HSO3-�� | 91��9 | 1��1 | 9��91 |
| pH | 8.2 | 7.2 | 6.2 |
�ڵ���Һ������ʱ������Ũ�ȹ�ϵ��ȷ����BC�����ţ���
A��c��Na+��=c��SO32-��+c��HSO3-��+c��H2SO3��
B��c��Na+����c��HSO3-����c��SO32-����c��H-��=c��OH-��
C��c��Na+��=2c��SO32-��+c��HSO3-��
��ʯ��ʯ����
�˷�����ʯ��ʯΪԭ��ͨ��ϵ�з�Ӧ����Ԫ����CaSO4����ʽ�̶����Ӷ�����SO2���ŷţ�����ú̿ȼ�չ����в�����CO�ֻ���CaSO4������ѧ��Ӧ����������Ч�ʣ���ط�Ӧ���Ȼ�ѧ����ʽ���£�
CaSO4��s��+CO��g���TCaO��s��+SO2��g��+CO2��g����H1=218.4kJ•mol-1����Ӧ��
CaSO4��s��+4CO��g���TCaS��s��+4CO2��g����H2=-175.6kJ•mol-1 ����Ӧ��
��ش��������⣺
��1����Ϸ�Ӧ��д��CaSO4��s����CaS��s����Ӧ���Ȼ�ѧ����ʽ3CaSO4��s��+CaS��s��=4CaO��s��+4SO2��g����H=1049.2kJ•mol-1��
��2�������������ķ�Ӧ����ʾƽ�ⳣ�� Kpʱ��������֣�B����ƽ��ѹǿp��B��������������ʵ���Ũ��c��B������Ӧ���Kp=$\frac{P��C{O}_{2}��P��S{O}_{2}��}{P��CO��}$���ñ���ʽ��ʾ����
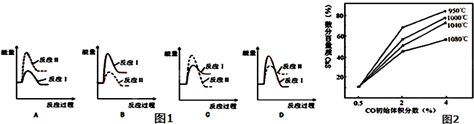
��3������ij�¶��£���Ӧ������ʣ�v1��С�ڷ�Ӧ������ʣ�v2���������з�Ӧ���������仯ʾ��ͼ����ͼ1��ʾ��������ȷ����B�����ţ���
��4��ͼ2Ϊʵ���ò�ͬ�¶��·�Ӧ��ϵ��CO��ʼ����ٷ�����ƽ��ʱ���������CaS�����ٷ����Ĺ�ϵ���ߣ��÷�Ӧ��ϵ�в�����SO2�������Ĵ�ʩ��AB�����ţ���
A����÷�Ӧ��ϵ��Ͷ����ʯ�� B���ں��ʵ��¶������ڿ��ƽϵ͵ķ�Ӧ�¶�
C������CO�ij�ʼ����ٷ��� D����߷�Ӧ��ϵ���¶ȣ�
 CO2��CH4��������Ҫ���������壬ͨ��CH4��CO2��Ӧ�������ֵ�Ļ�ѧƷ��Ŀǰ���о�Ŀ�꣮
CO2��CH4��������Ҫ���������壬ͨ��CH4��CO2��Ӧ�������ֵ�Ļ�ѧƷ��Ŀǰ���о�Ŀ�꣮��1��250��ʱ�������Ͻ�Ϊ��������4L������ͨ��6mol CO2��6mol CH4���������·�Ӧ��CO2��g��+CH4��g��?2CO��g��+2H2��g����ƽ����ϵ�и���ֵ�������������
| ���� | CH4 | CO2 | CO | H2 |
| ������� | 0.1 | 0.1 | 0.4 | 0.4 |
����֪��CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-890.3kJ•mol-1
CO��g��+H2O��g��=CO2��g��+H2��g����H=+2.8kJ•mol-1
2CO��g��+O2��g��=2CO2��g����H=-566.0kJ•mol-1
��ӦCO2��g��+CH4��g��?2CO��g��+2H2��g���ġ�H=247.3kJ•mol-1��
��2���Զ������ѱ��渲�ǵ�Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת����Ϊ���ᣮ
���ڲ�ͬ�¶��£������Ĵ�Ч����������������ʵı仯��ϵ��ͼ��ʾ��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ�����¶ȳ���250��ʱ�������Ĵ�Ч�ʽ��ͣ�
��Ϊ����߸÷�Ӧ��CH4��ת���ʣ����Բ�ȡ�Ĵ�ʩ������Ӧѹǿ������CO2��Ũ�ȣ�
�۽�Cu2Al2O4�ܽ���ϡ�����е����ӷ���ʽΪ3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO��+16H2O��
��3����CO2Ϊԭ�Ͽ��Ժϳɶ������ʣ�
�پ�̼������һ����������ͺϳɲ��ϣ�������CO2�Ӿ۶��ɵģ�д����̼�����Ľṹ��ʽ��
������������ˮ��Һ��Ϊ����ʽ��е�⣬CO2��ͭ�缫�Ͽ�ת��Ϊ���飬�缫��ӦʽΪCO2+8e-+6H2O=CH4+8OH-��

