题目内容
12. 一定条件下,在容积为3L的密闭容器中,发生反应CO(g)+2H2(g)?CH3OH(g)△H<0,在不同温度下甲醇的物质的量随时间的变化如图所示.下列叙述正确的是( )
一定条件下,在容积为3L的密闭容器中,发生反应CO(g)+2H2(g)?CH3OH(g)△H<0,在不同温度下甲醇的物质的量随时间的变化如图所示.下列叙述正确的是( )| A. | 平衡常数K(300℃)<K(500℃) | |
| B. | 500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=$\frac{nB}{3tB}$ mol•L-1•min-1 | |
| C. | 在其他条件不变的情况下,将处于E点的体系的容积压缩到原来的$\frac{1}{2}$,氢气的浓度减小 | |
| D. | 300℃,当容器内压强不变时说明反应已经达到平衡 |
分析 A、根据温度对化学平衡的影响,温度升高,平衡向吸热方向移动分析;
B、先根据图象计算甲醇的平均反应速率,同一时间内同一可逆反应中,各物质的反应速率之比等于其计量数之比;
C、增大压强,平衡向气体体积减小的方向移动;
D、该反应是一个反应前后气体体积改变的反应,当反应达到平衡状态时,混合气体的压强不变.
解答 解:A、反应CO(g)+2H2(g)?CH3OH(g)△H<0,升高温度,平衡逆向移动,K变小,K(300℃)>K(500℃),故A错误;
B、500℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=$\frac{nB}{3tB}$mol/(L•min),同一时间内同一可逆反应中,各物质的反应速率之比等于其计量数之比,所以v(H2)=$\frac{2nB}{3tB}$mol/(L•min),故B错误;
C、增大压强,平衡向气体减小的方向移动,但氢气的物质的量减小程度小于体积减小程度,所以氢气的物质的量浓度增大,故C错误;
D、该反应是一个反应前后气体体积改变的反应,但反应达到平衡状态时,各种气体的物质的量不变,则混合气体的压强不变,故D正确;
故选D.
点评 本题考查了物质的量随时间变化曲线,根据压强和温度对化学平衡的影响、反应速率公式等来分析解答,注意增大压强时,平衡向正反应方向移动,但氢气、一氧化碳浓度增大,为易错点.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
2.煤炭是我国的主要能源之一,与之伴生的二氧化硫(SO2)和酸雨污染问题较为突出,目前我国采用的控制方法是电厂烟气脱硫.烟气脱硫的原理是利用碱性物质吸收并固定酸性的二氧化硫,主要有如下两种方法:
Ⅰ.钠碱循环法脱硫技术
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:2OH-+SO2═SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
①由表判断,NaHSO3溶液显酸性,用化学平衡原理解释:溶液中存在HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,显酸性是因其电离大于其水解.
②当溶液呈中性时,离子浓度关系正确的是BC(填标号).
A.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
C.c(Na+)=2c(SO32-)+c(HSO3-)
Ⅱ.石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率,相关反应的热化学方程式如下:
CaSO4(s)+CO(g)═CaO(s)+SO2(g)+CO2(g)△H1=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)═CaS(s)+4CO2(g)△H2=-175.6kJ•mol-1 (反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s)反应的热化学方程式3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g)△H=1049.2kJ•mol-1.
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp=$\frac{P(C{O}_{2})P(S{O}_{2})}{P(CO)}$(用表达式表示).
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图(如图1所示)其中正确的是B(填标号).
(4)图2为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线,则降低该反应体系中产生的SO2生成量的措施有AB(填标号).
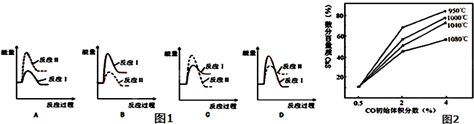
A.向该反应体系中投入生石灰 B.在合适的温度区间内控制较低的反应温度
C.降低CO的初始体积百分数 D.提高反应体系的温度.
Ⅰ.钠碱循环法脱硫技术
(1)此法是利用Na2SO3溶液可脱除烟气中的SO2.Na2SO3可由NaOH溶液吸收SO2制得,该反应的离子方程式:2OH-+SO2═SO32-+H2O.
(2)NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
②当溶液呈中性时,离子浓度关系正确的是BC(填标号).
A.c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
C.c(Na+)=2c(SO32-)+c(HSO3-)
Ⅱ.石灰石脱硫法
此法是以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率,相关反应的热化学方程式如下:
CaSO4(s)+CO(g)═CaO(s)+SO2(g)+CO2(g)△H1=218.4kJ•mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)═CaS(s)+4CO2(g)△H2=-175.6kJ•mol-1 (反应Ⅱ)
请回答下列问题:
(1)结合反应Ⅰ、Ⅱ写出CaSO4(s)与CaS(s)反应的热化学方程式3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g)△H=1049.2kJ•mol-1.
(2)对于气体参与的反应,表示平衡常数 Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应Ⅰ的Kp=$\frac{P(C{O}_{2})P(S{O}_{2})}{P(CO)}$(用表达式表示).
(3)假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图(如图1所示)其中正确的是B(填标号).
(4)图2为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线,则降低该反应体系中产生的SO2生成量的措施有AB(填标号).

A.向该反应体系中投入生石灰 B.在合适的温度区间内控制较低的反应温度
C.降低CO的初始体积百分数 D.提高反应体系的温度.
4.下列各表述与示意图一致的是( )
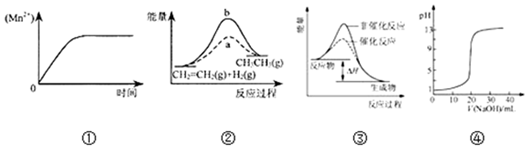

| A. | 图①表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混 合时,n(Mn2+) 随时间的变化 | |
| B. | 图②中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 | |
| C. | 图③表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图④表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得到的滴定曲线 |
1.对于容积不变的密闭容器发生中的可逆反应:mX(g)+nY(s)?pZ(g)△H<0,达到平衡后,改变条件,下列表述不正确的是( )
| A. | 增大压强,化学平衡不一定移动 | |
| B. | 通入氦气,化学平衡一定不发生移动 | |
| C. | 增加X或Y的物质的量,化学平衡一定发生移动 | |
| D. | 其它条件不变,升高温度,化学平衡一定发生移动 |
2.下列有关维生素的说法中不正确的是( )
| A. | 维生素是参与生物生长发育和新陈代谢所必需的一类高分子化合物 | |
| B. | 维生素C溶于水,溶液显酸性 | |
| C. | 生吃新鲜蔬菜要比熟吃时维生素C的损失小 | |
| D. | 含维生素C能使蓝色的碘的淀粉溶液褪色 |
