题目内容
18.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为吸热反应(填“吸热”、“放热”),写出该反应的平衡常数表达式:K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$.
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是bc.
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)能判断该反应是否达到化学平衡状态的依据是bc.
a.容器中压强不变 b.混合气体中 c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),试判断此时的温度为830℃.
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为b,CO2的物质的量为c.
a.等于1.0mol b.大于1.0mol
c.大于0.5mol,小于1.0mol d.无法确定.
分析 (1)由数据可知,平衡常数随温度升高增大,说明温度升高平衡正向进行;CO2(g)+H2(g)?CO(g)+H2O(g),平衡常数是利用生成物平衡浓度的幂次方乘积除以反应物平衡浓度幂次方乘积得到;
(2)a.及时分离出CO气体,反应速率减小;
b.适当升高温度,反应速率加快,且该反应为吸热反应;
c.增大CO2的浓度,反应物浓度增大;
d.选择高效催化剂,平衡不移动;
(3)结合平衡的特征“等、定”及衍生的物理量判定平衡状态;
(4)某温度下,各物质的平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),说明 K=1;
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2mol CO2和3mol H2充分反应达平衡时,设氢气消耗物质的量为x;
CO2(g)+H2(g)?CO(g)+H2O(g)
起始量(mol/L) 2 3 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 2-x 3-x x x
K=$\frac{{x}^{2}}{(2-x)(3-x)}$=1,以此来解答.
解答 解:(1)由图表数据可知,平衡常数随温度升高增大,说明温度升高平衡正向进行,正反应是吸热反应;CO2(g)+H2(g)?CO(g)+H2O(g),平衡常数是利用生成物平衡浓度的幂次方乘积除以反应物平衡浓度幂次方乘积得到,K=$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$,
故答案为:吸热;$\frac{c(CO)c({H}_{2}O)}{c(C{O}_{2})c({H}_{2})}$;
(2)a.及时分离出CO气体,反应速率减小,平衡正向移动,故错误;
b.适当升高温度,反应速率加快,平衡正向移动,故正确;
c.增大CO2的浓度反应速率加快,平衡正向移动,故正确;
d.选择高效催化剂,能使该反应的反应速率增大,但平衡不移动,故错误;
故答案为:bc;
(3)a、反应是一个反应前后体积不变的反应,压强的改变不会要引起平衡移动,故a错误;
b、化学平衡时,各组分的浓度不随时间的改变而改变,故b正确;
c、化学平衡状态的标志是v正=v逆,所以v正(H2)=v逆(H2O)表明反应达到平衡状态,故c正确;
d、c(CO2)=c(CO)时,不能表明正逆反应速率相等,不一定达到了平衡状态,故d错误;
故答案为:bc;
(4)某温度下,各物质的平衡浓度符合下式:c(CO2)•c(H2)=c(CO)•c(H2O),说明 K=1,对应的温度是830℃,
故答案为:830;
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2mol CO2和3mol H2充分反应达平衡时,设氢气消耗物质的量为x;
CO2(g)+H2(g)?CO(g)+H2O(g)
起始量(mol/L) 2 3 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 2-x 3-x x x
K=$\frac{{x}^{2}}{(2-x)(3-x)}$=1,解得x=1.2,反应达平衡时,H2的物质的量3mol-1.2mol=1.8mol,选b;CO2的物质的量为0.8mol,选c,
故答案为:b;c.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、平衡移动为解答的关键,侧重分析与计算能力的考查,注意K只与温度有关及表格数据应用,题目难度不大.

 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)+D(s)(放热反应),图中曲线b代表一定条件下该反应的过程,若使曲线b变为曲线a,可采取的措施是( )| A. | 增大A的浓度 | B. | 增大C的浓度 | C. | 加入催化剂 | D. | 升高温度 |
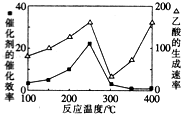 CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标.
CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标.(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分的体积分数如表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=247.3kJ•mol-1.
(2)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成为乙酸.
①在不同温度下,催化剂的催化效率与乙酸的生成速率的变化关系如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(3)以CO2为原料可以合成多种物质.
①聚碳酸酯是一种易降解的新型合成材料,它是由CO2加聚而成的.写出聚碳酸酯的结构简式:
②以氢氧化钾水溶液作为电解质进行电解,CO2在铜电极上可转化为甲烷,电极反应式为CO2+8e-+6H2O=CH4+8OH-.
| A. | c(HCO3-)>c(H2CO3) | B. | c(OH-)=2c(H+) | ||
| C. | c(Na+)=2c(CO32-) | D. | c(Na+)<c(CO32-)+c(HCO3-) |

 在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)
在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2 (g)?2SO3(g) (△H<0)