题目内容
19.分析城市空气样本,主要污染物为可吸入颗粒物pm2.5、NOx、SO2等,其主要来源为燃煤和机动车尾气排放等.(1)某同学为检测样本中所含成份,将样本用蒸馏水处理制成待测试样,设计实验及实验现象如图:

①该实验能确认存在的阳离子是Na+、NH4+、K+;.
②该实验检测出样本中有NO3-,根据是(用化学方程式解释)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2.
③根据该实验能否确定样本中含有SO32-,否(填“能”或“否”),若要确定SO32-,所需的实验药品可以是酸性高锰酸钾溶液.
(2)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是bc(填字母序号).
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(3)科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和Ca(NO2)2.
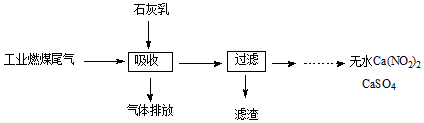
①CaSO4可以调节水泥的硬化时间.尾气中SO2与石灰乳反应生成CaSO4的化学方程式为2SO2+O2+2Ca(OH)2═2CaSO4+2H2O.
②Ca(NO2)2可制成混凝土防冻剂、钢筋阻锈剂等.尾气中NO、NO2与石灰乳反应生成Ca(NO2)2的化学方程式NO+NO2+Ca(OH)2═Ca(NO2)2+H2O.
分析 (1)①含有钠离子的物质焰色反应为黄色,含有钾离子的物质透过钴玻璃焰色反应呈现紫色;铵根离子可以和强碱共热反应产生氨气,能使石蕊试纸变蓝;金属铜可以和硝酸反应产生硝酸铜、一氧化氮和水,一氧化氮遇到空气迅速变为红棕色,硝酸银中的银离子可以和氯离子之间反应生成氯化银白色沉淀,硫酸根离子可以和钡离子反应产生白色不溶于盐酸的沉淀,据此回答;
②金属铜可以和硝酸反应产生硝酸铜、一氧化氮和水,一氧化氮遇到空气迅速变为红棕色;
③根据亚硫酸根离子具有还原性,可以和硝酸之间反应得到硫酸根离子来回答;
(2)a.PM2.5是指大气中直径小于或等于2.5μm的颗粒物.它的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物;
b.PM2.5表面积大,具有吸附性,能吸附大量有毒物质;
c.胶体微粒直径在10-7m~10-9m之间,PM2.5粒子的大小不符合;
d.减少机动车尾气排放,减少了烟尘,能降低空气中PM2.5;
(3)①尾气中SO2与氧气和石灰乳反应生成CaSO4和水;
②尾气中NO、NO2与石灰乳反应生成Ca(NO2)2和水,结合氧化还原反应的特征书写.
解答 解:(1)①物质焰色反应为黄色,所以含有钠离子,和强碱共热反应产生氨气,能使石蕊试纸变蓝,证明含有铵根离子,加入硝酸酸化的硝酸银会产生白色沉淀,证明含有氯离子或是亚硫酸根离子中的一种,先加盐酸再加入氯化钡,产生白色沉淀,证明含有硫酸根离子,溶液中加入几滴硫酸,再加入金属铜,可以产生红棕色的气体,证明原溶液含有硝酸根离子,透过钴玻璃观察焰色反应呈现紫色,证明含钾离子,一定含有的钾离子是Na+、NH4+、K+,
故答案为:Na+、NH4+、K+;
②溶液中加入几滴硫酸,再加入金属铜,可以产生红棕色的气体,证明原溶液含有硝酸根离子,金属铜可以和硝酸反应产生硝酸铜、一氧化氮和水,一氧化氮遇到空气迅速变为红棕色,即:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2,故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2;
③根据该实验不能确定样本中含有SO32-,加入硝酸酸化的硝酸银会产生白色沉淀,证明可能含有氯离子或是亚硫酸根离子中的一种,亚硫酸根离子可以和硝酸之间反应得到硫酸根离子,亚硫酸根离子可以使高锰酸钾褪色,但是硫酸根离子不能,可以采用高锰酸钾检验亚硫酸根离子的存在,故答案为:否;酸性高锰酸钾溶液;
(2)a.PM2.5是指大气中直径小于或等于2.5μm的颗粒物.它的主要来源是日常发电、工业生产、汽车尾气排放等过程中经过燃烧而排放的残留物,故a正确;
b.PM2.5表面积大,具有吸附性,能吸附大量有毒物质,故b错误;
c.胶体微粒直径在10-7m~10-9m之间,PM2.5粒子的大小不符合,故c错误;
d.减少机动车尾气排放,减少了烟尘,能降低空气中PM2.5,故d正确;
故选:bc;
(3)①尾气中SO2与氧气和石灰乳反应生成CaSO4和水,反应方程式为:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O故答案为:2SO2+O2+2Ca(OH)2═2CaSO4+2H2O;
②尾气中NO、NO2与石灰乳反应生成Ca(NO2)2和水,反应方程式为NO+NO2+Ca(OH)2═Ca(NO2)2+H2O;故答案为:NO+NO2+Ca(OH)2═Ca(NO2)2+H2O.
点评 本题考查了学生离子的检验知识,PM2.5、酸雨的形成、硫氮尾气的应用,注意离子伴随的特征离子反应是解题的关键,难度中等,抓好基础是关键.

 CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标.
CO2和CH4是两种主要的温室气体,通过CH4和CO2反应制造更高价值的化学品是目前的研究目标.(1)250℃时,以镍合金为催化剂,向4L容器中通入6mol CO2、6mol CH4,发生如下反应:CO2(g)+CH4(g)?2CO(g)+2H2(g).平衡体系中各组分的体积分数如表:
| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
②已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1
CO(g)+H2O(g)=CO2(g)+H2(g)△H=+2.8kJ•mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
反应CO2(g)+CH4(g)?2CO(g)+2H2(g)的△H=247.3kJ•mol-1.
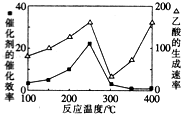
(2)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成为乙酸.
①在不同温度下,催化剂的催化效率与乙酸的生成速率的变化关系如图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250℃时,催化剂的催化效率降低.
②为了提高该反应中CH4的转化率,可以采取的措施是增大反应压强、增大CO2的浓度.
③将Cu2Al2O4溶解在稀硝酸中的离子方程式为3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
(3)以CO2为原料可以合成多种物质.
①聚碳酸酯是一种易降解的新型合成材料,它是由CO2加聚而成的.写出聚碳酸酯的结构简式:
②以氢氧化钾水溶液作为电解质进行电解,CO2在铜电极上可转化为甲烷,电极反应式为CO2+8e-+6H2O=CH4+8OH-.
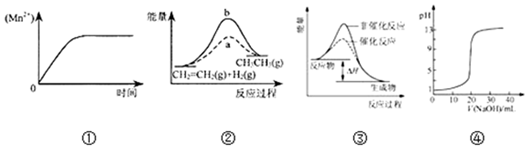
| A. | 图①表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混 合时,n(Mn2+) 随时间的变化 | |
| B. | 图②中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 | |
| C. | 图③表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图④表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得到的滴定曲线 |
(1)按物质的分类方法填写表格的空白处:(填编号)
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 |
(3)区别⑦和⑨的方法是丁达尔效应,将⑨滴加到⑦中至过量的实验现象是先产生红褐色沉淀,后沉淀溶解
(4)向⑧中通入③至恰好完全反应,则⑧的导电能力的变化为由弱变强
(5)将⑥的溶液滴加到⑤的溶液中至恰好沉淀为止时的离子方程式为Ba2++OH-+H++SO42-═BaSO4↓+H2O.
| A. | c(HCO3-)>c(H2CO3) | B. | c(OH-)=2c(H+) | ||
| C. | c(Na+)=2c(CO32-) | D. | c(Na+)<c(CO32-)+c(HCO3-) |
| A. | 强电解质的水溶液一定比弱电解质溶液的导电能力强 | |
| B. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| C. | 强电解质的水溶液中不存在溶质分子 | |
| D. | 不溶性盐都是弱电解质,可溶性盐都是强电解质 |

 2009年10月15日新华社报道:全国农村应当在“绿色生态•美丽多彩•低碳节能•循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
2009年10月15日新华社报道:全国农村应当在“绿色生态•美丽多彩•低碳节能•循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题: