题目内容
17.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.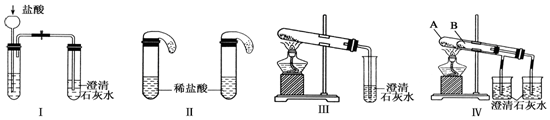
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填装置序号)II;
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其加热时都能发生的反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
(3)有同学认为,除上述试验方法外,向两种固体配成的溶液中加入澄清石灰水也可以区分它们,这种说法是错误(填“正确”或“错误”)的.其中向NaHCO3溶液中加入足量澄清石灰水,发生反应的离子方程式为:HCO3-+Ca2++OH-=CaCO3↓+H2O.
(4)另有两瓶溶液,已知分别是K2CO3溶液和NaHCO3溶液,请你写出鉴别方法.焰色反应,焰色反应呈紫色的是碳酸钾、呈黄色的是碳酸氢钠;滴加氯化钡溶液,有白色沉淀生成的是碳酸钾、否则是碳酸氢钠.
分析 (1)实验Ⅰ中,无论碳酸钠还是碳酸氢钠都能和盐酸反应生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;碳酸钠和盐酸反应分两步进行,盐酸和碳酸钠、碳酸氢钠反应都生成二氧化碳,二氧化碳能使澄清的石灰水变浑浊;
(2)碳酸氢钠不稳定,在加热条件下能分解生成碳酸钠、二氧化碳和水,碳酸钠较稳定,加热不易分解;
(3)加入澄清石灰水,均反应生成碳酸钙沉淀;碳酸氢钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠;
(4)阳离子不同,阴离子不同,结合性质差异鉴别.
解答 解:(1)Ⅰ装置反应现象相同;Ⅱ装置,向碳酸钠溶液中滴加盐酸先没有气体生成,随着盐酸的不断滴加,后产生气泡,向碳酸氢钠溶液中滴加盐酸立即产生气泡,所以能够达到实验目的是Ⅱ,
故答案为:Ⅱ;
(2)碳酸氢钠在加热条件下能分解生成碳酸钠、水和二氧化碳,发生反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,生成的二氧化碳与澄清石灰水反应生成碳酸钙,反应方程式为CO2+Ca(OH)2=CaCO3↓+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(3)加入澄清石灰水,均反应生成碳酸钙沉淀,现象相同,不能鉴别,则说法错误,碳酸氢钠和足量氢氧化钠反应生成碳酸钙沉淀和NaOH,离子方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O,
故答案为:错误;HCO3-+Ca2++OH-=CaCO3↓+H2O;
(4)阳离子不同,利用焰色反应可鉴别,隔蓝色钴玻璃能看到紫色焰色的是K2CO3,否则是NaHCO3;阴离子不同,滴加氯化钡溶液可鉴别,滴加氯化钡生成白色沉淀的为K2CO3,无现象的是NaHCO3,
故答案为:焰色反应,焰色反应呈紫色的是碳酸钾、呈黄色的是碳酸氢钠;滴加氯化钡溶液,有白色沉淀生成的是碳酸钾、否则是碳酸氢钠.
点评 本题考查物质的性质及鉴别,为高频考点,把握碳酸钠、碳酸氢钠的性质差异为解答的关键,侧重分析与实验能力的考查,题目难度不大.

| A. | c(HCO3-)>c(H2CO3) | B. | c(OH-)=2c(H+) | ||
| C. | c(Na+)=2c(CO32-) | D. | c(Na+)<c(CO32-)+c(HCO3-) |
| A. | 维生素是参与生物生长发育和新陈代谢所必需的一类高分子化合物 | |
| B. | 维生素C溶于水,溶液显酸性 | |
| C. | 生吃新鲜蔬菜要比熟吃时维生素C的损失小 | |
| D. | 含维生素C能使蓝色的碘的淀粉溶液褪色 |
| A. | 强电解质的水溶液一定比弱电解质溶液的导电能力强 | |
| B. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| C. | 强电解质的水溶液中不存在溶质分子 | |
| D. | 不溶性盐都是弱电解质,可溶性盐都是强电解质 |
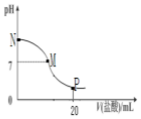 向10.0mL0.10mol•L-1氨水中滴入0.1mol•L-1盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体移出),下列有关叙述正确的是( )
向10.0mL0.10mol•L-1氨水中滴入0.1mol•L-1盐酸,溶液的pH与所加盐酸的体积关系如图所示(假设无气体移出),下列有关叙述正确的是( )| A. | M-N间一定存在c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | M点对应的盐酸体积为10.0mL | |
| C. | pH=7溶液中存在c(Cl-)=c(NH4+)=c(OH-)=c(H+) | |
| D. | p点处的溶液中存在:2 c(NH4+)+2c(NH3•H2O)=c(Cl-) |
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、Cu2+、SO42-、Cl- | D. | Na+、H+、Cl-、CO32- |




