题目内容
15.(1)已知下列反应:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-266kJ/mol
试回答:
(1)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:CO(g)+Na2O2(s)=Na2CO3(s)△H=-549 kJ/mol.
(2)沼气是一种能源,它主要成分是CH4.0.5mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量,则其燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ•moL-1.
(3)SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2(s)和H2O(l),已知室温下3.2gSiH4自燃放出热量79.2kJ,其热化学方程式为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=-792kJ/mol.
分析 (1)依据热化学方程式和盖斯定律计算构造所需热化学方程式得到反应的焓变,由盖斯定律:$\frac{1}{2}$×①+②得CO(g)+Na2O2(s)=Na2CO3(s);
(2)书写时注意反应热的数值应为1mol甲烷燃烧放出的热量;
(3)根据甲硅烷的质量计算1mol甲硅烷燃烧放出的热量,结合化学方程式书写热化学方程式.注意物质的聚集状态和反应热的单位等问题.
解答 解:(1)已知①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
②Na2O2(s)+CO2(g)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-266kJ/mol,
由盖斯定律:$\frac{1}{2}$×①+②得CO(g)+Na2O2(s)=Na2CO3(s)△H=$\frac{1}{2}$×(-566)+(-266)=-549 kJ/mol,
故答案为:CO(g)+Na2O2(s)=Na2CO3(s)△H=-549 kJ/mol;
(2)0.5mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量,所以1mol甲烷完全燃烧生成液态水时能放出890kJ的热量,故甲烷燃烧生成液态水时的热化学反应方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ•moL-1,故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ•moL-1;
(3)n(SiH4)=$\frac{3.2g}{32g/mol}$=0.1mol,则1molSiH4燃烧放出的热量为:792kJ,
反应的化学方程式为:SiH4+O2=SiO2+2H2O,则热化学方程式为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=-792kJ/mol,
故答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=-792kJ/mol.
点评 本题考查热化学方程式的书写,为高频考点,把握物质的量与热量的关系、热化学方程式的书写方法等为解答的关键,侧重分析与计算能力的考查,注意放热反应的焓变为负值,题目难度不大.

| A. | 称量时托盘上要垫上干净的称量纸 | |
| B. | 移液时不慎有部分液体溅出,会造成所配溶液浓度偏小 | |
| C. | 定容时俯视容量瓶刻度线,会造成所配溶液浓度偏大 | |
| D. | 定容摇匀后发现液面下降,不应再加蒸馏水 |
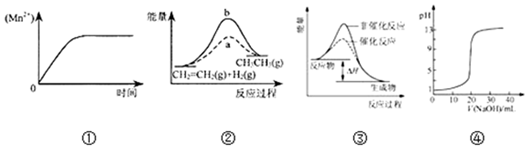
| A. | 图①表示10 mL 0.01 mol•L-1 KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混 合时,n(Mn2+) 随时间的变化 | |
| B. | 图②中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 | |
| C. | 图③表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| D. | 图④表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1CH3COOH溶液所得到的滴定曲线 |

