题目内容
19.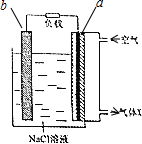 镁-空气电池的工作原理如图所示.下列说法不正确的是( )
镁-空气电池的工作原理如图所示.下列说法不正确的是( )| A. | 工作一段时间后,c(Na+)变大 | B. | 气体X中N2的百分量与空气相同 | ||
| C. | 电池工作时,OH-向a极移动 | D. | 电池总反应为2Mg+O2+2H2O═2Mg(OH)2 |
分析 镁-空气电池中,负极金属Mg失去电子生成Mg2+,正极氧气得到电子生成OH-,电池总反应为:2Mg+O2+2H2O═2Mg(OH)2;根据反应方程式可知,工作一段时间后,水的量减小,则c(Na+)变大;空气中氧气被消耗,则气体X中N2的百分量大于空气;然后结合电解质溶液电流从负极流向正极分析氢氧根离子的移动方向.
解答 解:镁-空气电池中,负极金属Mg失去电子生成Mg2+,正极氧气得到电子生成OH-,电池总反应为:2Mg+O2+2H2O═2Mg(OH)2,
A.根据反应方程式可知,工作一段时间后,水的量减小,则c(Na+)变大,故A正确;
B.原电池工作时消耗空气中的氧气,则气体X中N2的百分量大于空气,故B错误;
C.电解质溶液中,电流从负极流向正极,则氢氧根离子向a极移动,故C正确;
D.根据分析可知,电池总反应为:2Mg+O2+2H2O═2Mg(OH)2,故D正确;
故选B.
点评 本题考查原电池工作原理,题目难度中等,明确电极上得失电子及反应是解本题关键,注意掌握原电池两极及总反应式的书写方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
7.下列各组中的比值等于2:1的是( )
| A. | pH均为12的烧碱溶液与氢氧化钡溶液的物质的量浓度之比 | |
| B. | 硫化钾溶液中c(K+)与c(S2-)之比 | |
| C. | 相同温度下0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中c(H+)之比 | |
| D. | 10mL 0.5mol•L-1的盐酸溶液与5mL 0.5mol•L-1的醋酸溶液中的n(H+)之比 |
14.室温下,下列溶液中微粒浓度关系一定正确的是( )
| A. | 室温下c(NH4+)相同的下列溶液:①NH4Al(SO4)2②NH4Cl③CH3COONH4,物质的量浓度由大到小的顺序为②>①>③ | |
| B. | 0.001mol•L-1氯水中:c(Cl2)+c(Cl-)+c(ClO-)+c(HClO)=0.01mol•L-1 | |
| C. | amol•L-1的醋酸与0.01mol•L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的Ka=5×10-10/(a/2-0.005) | |
| D. | 向5mL含KCl和Kl浓度均为0.01mol•L-1的混合溶液中,滴加8mL0.01mol•L-1的AgNO3溶液,所得溶液中离子浓度大小关系为c(NO3-)>c(K+)>c(Cl-)>c(I-)>c(Ag+) |
4.25℃时相同浓度的下列溶液中,导电能力最强的是( )
| A. | H2O | B. | NH3•H2O | C. | CH3COOH | D. | NaCl |
18.常温下,2L物质的量浓度为0.5mol•L-1KOH溶液含有( )
| A. | 0.5mol的K+ | B. | 0.5mol的H+ | C. | 1.0mol的H+ | D. | 1.0mol的OH- |
19.一只规格为amL的滴定管,其尖嘴部分充满溶液,管内液面在mmL处,当液面降到n mL处时,下列判断正确的是( )
| A. | 流出溶液的体积为(m-n)mL | B. | 流出溶液的体积为(n-m)mL | ||
| C. | 管内溶液体积等于(a-n)mL | D. | 管内溶液体积多于nmL |
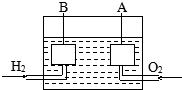 宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.
宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.