题目内容
14.室温下,下列溶液中微粒浓度关系一定正确的是( )| A. | 室温下c(NH4+)相同的下列溶液:①NH4Al(SO4)2②NH4Cl③CH3COONH4,物质的量浓度由大到小的顺序为②>①>③ | |
| B. | 0.001mol•L-1氯水中:c(Cl2)+c(Cl-)+c(ClO-)+c(HClO)=0.01mol•L-1 | |
| C. | amol•L-1的醋酸与0.01mol•L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的Ka=5×10-10/(a/2-0.005) | |
| D. | 向5mL含KCl和Kl浓度均为0.01mol•L-1的混合溶液中,滴加8mL0.01mol•L-1的AgNO3溶液,所得溶液中离子浓度大小关系为c(NO3-)>c(K+)>c(Cl-)>c(I-)>c(Ag+) |
分析 A.NH4Al(SO4)2溶液中铵根离子与铝离子水解相互抑制,CH3COONH4中铵根离子与醋酸根离子水解相互促进;
B.根据氯水中的物料守恒判断;
C.根据电荷守恒及反应平衡时溶液中c(Na+)=c(Ac-),利用离子浓度来计算电离常数;
D.计算出混合液中钾离子和硝酸根离子的物质的量,然后判断二者浓度大小.
解答 解:A.NH4Al(SO4)2溶液中铵根离子与铝离子水解相互抑制,CH3COONH4中铵根离子与醋酸根离子水解相互促进,所以相同物质的量浓度的下列溶液中:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,则c(NH4+)由大到小的顺序是:①>②>③,故A错误;
B.0.001mol•L-1氯水中,根据物料守恒可得:2c(Cl2)+c(Cl-)+c(ClO-)+c(HClO)=0.02mol•L-1,故B错误;
C.a mol•L-1的醋酸与0.01 mol•L-1的氢氧化钠溶液等体积混合后呈中性,则c(OH-)=c(H+)=10-7mol/L,c(Na+)=c(Ac-)=0.005mol/L,醋酸的Ka=$\frac{0.005×1{0}^{-7}}{\frac{1}{2}(a-0.01)}$=$\frac{5×1{0}^{-10}}{\frac{1}{2}a-0.005}$,故C正确;
D.5mL含KCl和KI浓度均为0.01mol•L-1的混合溶液中,滴加8mL0.01mol•L-1的AgNO3溶液,钾离子的总物质的量为:0.005×0.01mol/L+0.005×0.01mol/L=1×10-4mol,
硝酸根离子的物质的量为:n(NO3-)=0.008L×0.01mol/L=8×10-5mol,反应中硝酸根离子和钾离子都不发生反应,则在同一溶液中一定满足:c(K+)>c(NO3-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐的水解原理、弱电解质的电离、难溶物溶解平衡等知识,明确电荷守恒、物料守恒的含义为解答关键,试题培养了学生的灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | K2SO4、HNO3、BaCl2 | B. | NaOH、NaCl、CuCl2 | ||
| C. | BaCl2、Na2CO3、HCl | D. | KCl、H2SO4、AgNO3 |
| A. | 二氧化硅溶于水显酸性 | |
| B. | 二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到白色胶状物质 | |
| C. | 因为高温时,二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 | |
| D. | 二氧化硅是酸性氧化物,它不溶于任何酸 |
| A. | 13.3% | B. | 26.6% | C. | 20% | D. | ≥20% |
| A. | 若c(CH3COOH)=0.1mol/L,反应后的溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) | |
| B. | 若c(CH3COOH)=0.1mol/L,反应后的溶液中:c(OH-)>c(CH3COOH)+c(H+) | |
| C. | 若c(CH3COOH)=0.2mol/L,反应后的溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| D. | 若反应后的溶液呈中性,则:c(CH3COOH)+c(CH3COO-)>0.05mol/L |
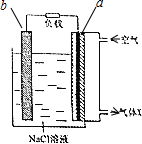 镁-空气电池的工作原理如图所示.下列说法不正确的是( )
镁-空气电池的工作原理如图所示.下列说法不正确的是( )| A. | 工作一段时间后,c(Na+)变大 | B. | 气体X中N2的百分量与空气相同 | ||
| C. | 电池工作时,OH-向a极移动 | D. | 电池总反应为2Mg+O2+2H2O═2Mg(OH)2 |
| A. | 5 | B. | 9 | C. | 7 | D. | 14 |
| A. | 氮气  | B. | 氯化氢  | C. | 氨气  | D. | 氯化镁 |
| A. | 当x=2时,每生成lmolN2,转移电子数为4mol | |
| B. | 该反应中化合价变化的有N和C元素 | |
| C. | 等物质的量N2和C02中,共用电子对的个数比为3:4 | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |