题目内容
1.有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等物质组成.某同学为了鉴别它们,做了如下实验:①将固体混合物溶于水,搅拌后得无色透明溶液;
②在①所得的溶液中滴加Ba(NO3)2溶液,有白色沉淀生成,并继续滴加至沉淀完全;
③过滤,然后在所得白色沉淀上加入过量稀硝酸,沉淀部分溶解.
根据该同学实验请你回答:
(1)原混合物中肯定有Na2CO3、Na2SO4,肯定没有CuSO4、CaCl2,可能含有NaCl.
(2)写出上述实验过程中,可能发生反应的离子方程式:Ba2++CO32-═BaCO3↓、Ba2++SO42-═BaSO4↓、BaCO3+2H+═Ba2++H2O+CO2↑.
(3)要检验可能含有的物质可采用的方法是取③的滤液少许于试管中,先用稀硝酸酸化,然后加入AgNO3溶液,观察是否有白色沉淀生成.
分析 由(1)混合物溶于水,搅拌后得无色透明溶液,则一定不含CuSO4;且Na2CO3、Na2SO4与CaCl2不能同时存在;
由(2)此溶液中滴加硝酸钡溶液,有白色沉淀生成,则白色沉淀为碳酸钡或硫酸钡,
再结合(3)可知白色沉淀部分溶解在硝酸中,则白色沉淀为碳酸钡和硫酸钡,以此解答该题.
解答 解:由(1)混合物溶于水,搅拌后得无色透明溶液,则一定不含CuSO4;且Na2CO3、Na2SO4与CaCl2不能同时存在;
由(2)此溶液中滴加硝酸钡溶液,有白色沉淀生成,则白色沉淀为碳酸钡或硫酸钡,再结合(3)可知白色沉淀部分溶解在硝酸中,则白色沉淀为碳酸钡和硫酸钡,则一定含Na2CO3、Na2SO4不含CaCl2,不能确定是否含NaCl,
(1)由以上分析可知,原混合物中肯定有Na2CO3、Na2SO4,肯定没有CuSO4、CaCl2,可能含有NaCl,
故答案为:Na2CO3、Na2SO4;CuSO4、CaCl2;NaCl;
(2)滴加Ba(NO3)2溶液,有白色沉淀生成发生Ba2++CO32-═BaCO3↓、Ba2++SO42-═BaSO4↓,过滤,然后在所得白色沉淀上加入过量稀硝酸,沉淀部分溶解,涉及反应为BaCO3+2H+═Ba2++H2O+CO2↑,
故答案为:Ba2++CO32-═BaCO3↓;Ba2++SO42-═BaSO4↓;BaCO3+2H+═Ba2++H2O+CO2↑;
(3)检验是否含NaCl,先加硝酸,无现象,再加硝酸银观察是否生成白色沉淀可检验,操作方法有取③的滤液少许于试管中,先用稀硝酸酸化,然后加入AgNO3溶液,观察是否有白色沉淀生成,
故答案为:取③的滤液少许于试管中,先用稀硝酸酸化,然后加入AgNO3溶液,观察是否有白色沉淀生成.
点评 本题考查无机物的推断,为高频考点,侧重于考查学生的综合分析能力,把握物质的性质、发生的反应逐一分析推断即可解答,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 按系统命名法,CH3CH(C2H5)CH(C2H5)CH3的名称是2,3-二乙基丁烷 | |
| B. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 | |
| C. | 通过石油裂解可以得到乙烯、丙烯、甲烷、苯、甲苯等重要化工基本原料 | |
| D. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质 |
| A. | 13.3% | B. | 26.6% | C. | 20% | D. | ≥20% |
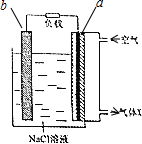 镁-空气电池的工作原理如图所示.下列说法不正确的是( )
镁-空气电池的工作原理如图所示.下列说法不正确的是( )| A. | 工作一段时间后,c(Na+)变大 | B. | 气体X中N2的百分量与空气相同 | ||
| C. | 电池工作时,OH-向a极移动 | D. | 电池总反应为2Mg+O2+2H2O═2Mg(OH)2 |
| A. | 5 | B. | 9 | C. | 7 | D. | 14 |
| A. | 氮气  | B. | 氯化氢  | C. | 氨气  | D. | 氯化镁 |
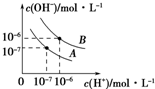 已知水在25℃和95℃时,其电离平衡曲线如图所示.
已知水在25℃和95℃时,其电离平衡曲线如图所示.