题目内容
18.常温下,2L物质的量浓度为0.5mol•L-1KOH溶液含有( )| A. | 0.5mol的K+ | B. | 0.5mol的H+ | C. | 1.0mol的H+ | D. | 1.0mol的OH- |
分析 根据n=cV计算KOH的物质的量,溶液中KOH完全电离n(K+)=n(KOH),溶液中OH-离子来源于KOH、水的电离,H+来源于水的电离,碱性条件下其浓度很小.
解答 解:溶液中KOH的物质的量=2L×0.5mol/L=1mol,溶液中KOH完全电离n(K+)=n(KOH)=1mol,KOH电离的OH-为1mol,溶液中OH-离子主要来源于KOH,水电离出的确氢氧根可以忽略不计,故n(OH-)=1mol,H+来源于水的电离,碱性条件下H+浓度很小,溶液中n(H+)远远小于1mol.
故选D.
点评 本题考查物质的量浓度有关计算,难度不大,D选项为易错点,学生容易忽略水电离产生氢氧根离子.

练习册系列答案
相关题目
19.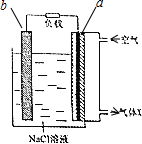 镁-空气电池的工作原理如图所示.下列说法不正确的是( )
镁-空气电池的工作原理如图所示.下列说法不正确的是( )
 镁-空气电池的工作原理如图所示.下列说法不正确的是( )
镁-空气电池的工作原理如图所示.下列说法不正确的是( )| A. | 工作一段时间后,c(Na+)变大 | B. | 气体X中N2的百分量与空气相同 | ||
| C. | 电池工作时,OH-向a极移动 | D. | 电池总反应为2Mg+O2+2H2O═2Mg(OH)2 |
13.下列各电子式中书写正确的是( )
| A. | 氮气  | B. | 氯化氢  | C. | 氨气  | D. | 氯化镁 |
3.根据表中的信息判断下列说法错误的是( )
| 物质 | 外观 | 熔点 | 燃烧热/(kJ•mol-1) |
| 金刚石 | 无色,透明固体 | ? | 395.4 |
| 石墨 | 灰黑,不透明固体 | ? | 393.5 |

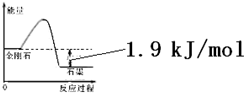
| A. | 由表中信息可得如右图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol | |
| C. | 由表中信息可推知相同条件下金刚石的熔点低于石墨的熔点 | |
| D. | 表示石墨燃烧热的热化学方程式为C(石墨,s)+$\frac{1}{2}$O2(g)=CO(g)△H=-393.5kJ/mol |
7.对于0.1mol•L-1Na2CO3溶液,下列描述正确的是( )
| A. | 升高温度,溶液中c(OH-)降低 | B. | 加入少量NaOH固体,c(CO32-)增大 | ||
| C. | c(Na+)═2c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(Na+)+c(H+)═2c(CO32-)+2c(HCO3-)+c(OH-) |
8.同温同压条件下,在两个容积相同的密闭容器中,一个盛有NH3,另一个盛有N2、H2的混合气体,两容器内的气体一定具有相同的( )
| A. | 原子数 | B. | 分子数 | C. | 质量 | D. | 密度 |
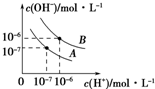 已知水在25℃和95℃时,其电离平衡曲线如图所示.
已知水在25℃和95℃时,其电离平衡曲线如图所示.