题目内容
10.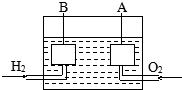 宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.
宇宙飞船上使用的氢氧燃料电池是一种新型化学电池,其构造如图所示,A、B是多孔性炭制成的两个电极,通入的气体由孔隙中逸出,并在电极表面放电.(1)若电解质溶液为KOH溶液,则正极是A,(填字母)正极电极反应式为O2+2H2O+4e-=4OH-;负极电极反应式为2H2+4OH--4e-=4H2O;一段时间后,溶液的pH变小(填“变大”“变小”或“不变”).
(2)若电解质溶液为H2SO4溶液,则正极发生的反应为O2+4H++4e-═2H2O;.
(3)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s).该电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq).负极电极反应式为Zn-2e-+2OH-═Zn(OH)2.
分析 (1)(2)根据反应2H2+O2=2H2O可知,反应中氢气失电子被氧化,应在负极上的反应,氧气得电子被还原,应在正极上的反应,根据得失电子及反应类型写出相应的电极反应式,根据溶液中氢离子浓度的变化判断溶液pH值的变化;
(3)该原电池中,Zn失电子作负极、二氧化锰作正极,负极反应式为Zn-2e-+2OH-═Zn(OH)2,正极反应式为2MnO2+H2O+2e-=Mn2O3+2OH-,据此分析解答.
解答 解:(1)该反应中氢气失电子被氧化为负极,氢气失电子生成氢离子,氢离子和溶液中的氢氧根离子生成水,所以电极反应式为2H2+4OH--4e-=4H2O.
氧气得电子被还原为正极,氧气得电子和水反应生成氢氧根离子,所以电极反应式为O2+2H2O+4e-=4OH-.
随着反应的进行,生成的水越来越多,溶质氢氧化钾的量不变,所以导致溶液的浓度降低,所以溶液的PH值减小.
故答案为:A;O2+2H2O+4e-=4OH-;2H2+4OH--4e-=4H2O;变小;
(2)该反应中氢气失电子被氧化为负极,在酸性条件下氢气失电子生成氢离子,电极反应式为2H2-4e-═4H+,正极氧气得电子被还原,氧气得电子和溶液中的氢离子生成水,所以电极反应式为O2+4H++4e-═2H2O;故答案为:O2+4H++4e-═2H2O;
(3)电池负极为Zn,碱性条件下负极的电极反应式为:Zn-2e-+2OH-═Zn(OH)2,故答案为:Zn-2e-+2OH-═Zn(OH)2.
点评 本题考查了原电池原理和电极反应式的书写,难度不大,要注意的是写电极反应式要结合电解质溶液,如果电解质溶液不同,即使原料相同,电极反应式也不同,如氢氧燃料电池,当电解质为酸或碱,电极反应式不同.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.氯碱工业电解所用的氯化钠溶液需精制.除去有影响的Ca2+,Mg2+,NH4+,SO42-及泥沙,其精制流程如下:
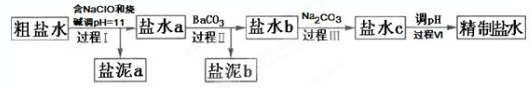
已知:①Ca2+,Mg2+开始形成相应氢氧化物沉淀的pH如表:
②Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9,Ksp(CaCO3)=5.0×10-9.
下列说法正确的是( )

已知:①Ca2+,Mg2+开始形成相应氢氧化物沉淀的pH如表:
| Ca(OH)2 | Mg(OH)2 | |
| pH | ≥11.5 | ≥4.2 |
下列说法正确的是( )
| A. | 盐泥a除泥沙外,还含有Ca(OH)2和Mg(OH)2 | |
| B. | 过程Ⅰ中NH4+转化为N2的离子方程式是3ClO-+2NH4+═3Cl-+N2↑+3H2O+2H+ | |
| C. | 过程Ⅱ中通入CO2有利于除SO42- | |
| D. | 过程Ⅳ调pH可以使用硝酸 |
1.下列说法正确的是( )
| A. | 按系统命名法,CH3CH(C2H5)CH(C2H5)CH3的名称是2,3-二乙基丁烷 | |
| B. | 等质量的甲醛与乳酸[CH3CH(OH)COOH]完全燃烧消耗氧气的量不相等 | |
| C. | 通过石油裂解可以得到乙烯、丙烯、甲烷、苯、甲苯等重要化工基本原料 | |
| D. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质 |
5.下列说法正确的是( )
| A. | 二氧化硅溶于水显酸性 | |
| B. | 二氧化碳通入水玻璃(Na2SiO3的水溶液)可以得到白色胶状物质 | |
| C. | 因为高温时,二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 | |
| D. | 二氧化硅是酸性氧化物,它不溶于任何酸 |
15.将SO2气体通入CaCl2溶液,若要有白色沉淀产生,可加入的试剂是( )
| A. | 氯化钾溶液 | B. | 碳酸氢钙溶液 | C. | 氯水 | D. | 氢氧化钠溶液 |
2.向40g NaOH溶液中投入5.4g Al,反应完全后放出0.3mol H2,此NaOH溶液的百分比浓度为( )
| A. | 13.3% | B. | 26.6% | C. | 20% | D. | ≥20% |
19.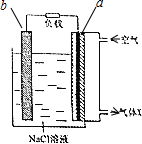 镁-空气电池的工作原理如图所示.下列说法不正确的是( )
镁-空气电池的工作原理如图所示.下列说法不正确的是( )
 镁-空气电池的工作原理如图所示.下列说法不正确的是( )
镁-空气电池的工作原理如图所示.下列说法不正确的是( )| A. | 工作一段时间后,c(Na+)变大 | B. | 气体X中N2的百分量与空气相同 | ||
| C. | 电池工作时,OH-向a极移动 | D. | 电池总反应为2Mg+O2+2H2O═2Mg(OH)2 |
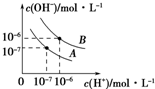 已知水在25℃和95℃时,其电离平衡曲线如图所示.
已知水在25℃和95℃时,其电离平衡曲线如图所示.