题目内容
11.下列分子中所有原子都满足最外层为8个电子结构的是( )| A. | BCl3 | B. | NCl3 | C. | H2S | D. | BeCl2 |
分析 对于ABn型共价化合物元素化合价绝对值+元素原子的最外层电子数=8,则该元素原子满足8电子结构,据此判断.
解答 解:A.BCl3中B元素化合价为+3,B原子最外层电子数为3,所以3+3=6,B原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,F原子满足8电子结构,故A错误;
B.NCl3中N元素化合价为+3,N原子最外层电子数为5,所以3+5=8,N原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故B正确;
C.H2S中S元素化合价为-2,S原子最外层电子数为6,所以2+6=8,S原子满足8电子结构;H元素化合价为+1,H原子最外层电子数为1,所以1+1=2,H原子不满足8电子结构,故C错误;
D.BeCl2中Be元素化合价为+2,Be原子最外层电子数为2,所以2+2=4,Be原子不满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故D错误;
故选B.
点评 本题考查8电子结构的判断,难度不大,清楚元素化合价绝对值+元素原子的最外层电子数=8,则该元素原子满足8电子结构是关键,注意离子化合物不适合.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
1.下表是元素周期表的一部分,针对表中的①-⑧种元素,填写下列空白;
(1)上述元素中,形成化合物种类最多的是C(填元素符号);
(2)元素①的非金属性比元素⑥强,可以用来证明该结论的事实是:碳酸的酸性比硅酸的酸性强;
(3)元素②的气态氢化物与⑧的单质发生置换反应的方程式为2NH3+Cl2=N2+6HCl;
(4)元素③和④形成的化合物中可以做供氧剂、漂白剂的是Na2O2(填化学式);
(5)元素③、⑤和⑦形成的化合物常用于工业污水的处理,其主要作用为铝离子水解生成胶体具有吸附性,可净化水.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)元素①的非金属性比元素⑥强,可以用来证明该结论的事实是:碳酸的酸性比硅酸的酸性强;
(3)元素②的气态氢化物与⑧的单质发生置换反应的方程式为2NH3+Cl2=N2+6HCl;
(4)元素③和④形成的化合物中可以做供氧剂、漂白剂的是Na2O2(填化学式);
(5)元素③、⑤和⑦形成的化合物常用于工业污水的处理,其主要作用为铝离子水解生成胶体具有吸附性,可净化水.
20.下列叙述错误的是( )
| A. | 盛装在敞口玻璃容器中的碘化钾溶液,在空气中久置后,可能会显黄色 | |
| B. | 次氯酸不稳定,见光即分解,可与强碱发生中和反应,则证明次氯酸为弱酸 | |
| C. | 铜粉在氯气中燃烧生成棕色的烟 | |
| D. | 氯水久置后溶液的酸性增强 |
1.有关下列图象的说法不正确的是( )
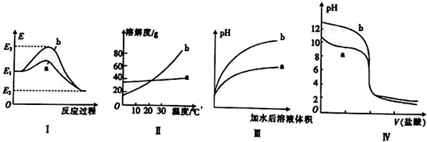

| A. | 图Ⅰ表法某放热反应过程中的能量变化,则曲线a可表示加入催化剂的反应 | |
| B. | 图Ⅱ表示两种盐的溶解度曲线,在较高温度下制得浓溶液再冷却结晶,过滤、洗涤、干燥可得纯净的固体a | |
| C. | 图Ⅲ表示相同pH的盐酸和醋酸分别用水稀释,则曲线a为醋酸 | |
| D. | 图Ⅳ表示相同物质的量浓度的NaOH溶液和氨水分别用盐酸滴定的曲线,则曲线a表示氨水 |

 (X为卤素原子)
(X为卤素原子)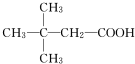 (用结构简式表示).
(用结构简式表示).

 ,空间结构是平面型分子;
,空间结构是平面型分子;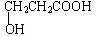 ;若甲能发生银镜反应,则甲的结构简式为
;若甲能发生银镜反应,则甲的结构简式为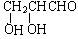 .
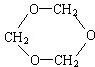
.
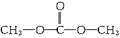 .
.