题目内容
6.有①${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O ②H2、D2、T2 ③石墨、金刚石 ④${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H四组微粒或物质.回答下列问题:(1)互为同位素的是①④(填编号).
(2)现有11g由${\;}_{1}^{2}$H和${\;}_{8}^{18}$O组成的水分子,其中含中子数6mol.
分析 (1)质子数相同中子数不同的同一元素的不同原子互称同位素;
(2)根据n=$\frac{m}{M}$计算2H218O的物质的量,每个2H218O分子含有12个中子.
解答 解:(1)①${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O质子数都为8,中子数分别为8、9、10,故互为同位素;
②H2、D2、T2 是由氢的同位素原子构成的氢分子,不是同位素;
③石墨、金刚石都是由碳元素形成的不同单质,互为同素异形体,不是同位素;
④${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H质子数都为1,中子数分别为0、1、2,故互为同位素;
故答案为:①④;
(2)由${\;}_{1}^{2}$H和${\;}_{8}^{18}$O组成的水分子2H218O,其相对分子质量为22,则11g的物质的量为n=$\frac{m}{M}$=$\frac{11g}{22g/mol}$=0.5mol,其中含中子数为(2×1+18-8)×0.5mol=6mol,
故答案为:6.
点评 本题考查物质的量的计算以及原子结构,侧重于学生的分析能力和计算能力的考查,题目难度不大,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.表是元素周期表一部分,列出了九种元素在周期表中的位置:
请用化学用语回答下列问题
(1)在上述元素中,非金属性最强的是F,在③~⑦元素中,原子半径最大的是Mg;
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式).写出①和④的最高价氧化物对应的水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
(3)用电子式表示③和⑨形成的化合物的形成过程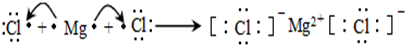 .
.
(4)表中元素①和⑦可以形成一种淡黄色物质X,写出X的电子式: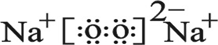 ,该物质所含化学键类型离子键和共价键,0.1mol X与水反应转移电子数为:0.1NA.
,该物质所含化学键类型离子键和共价键,0.1mol X与水反应转移电子数为:0.1NA.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 3 | ① | ③ | ④ | ⑨ | ||||
| 4 | ② |
(1)在上述元素中,非金属性最强的是F,在③~⑦元素中,原子半径最大的是Mg;
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式).写出①和④的最高价氧化物对应的水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
(3)用电子式表示③和⑨形成的化合物的形成过程
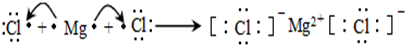 .
.(4)表中元素①和⑦可以形成一种淡黄色物质X,写出X的电子式:
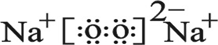 ,该物质所含化学键类型离子键和共价键,0.1mol X与水反应转移电子数为:0.1NA.
,该物质所含化学键类型离子键和共价键,0.1mol X与水反应转移电子数为:0.1NA.
19.下列物质能使酸性高锰酸钾溶液褪色的是( )
| A. | 二氧化硫 | B. | 苯 | C. | 乙醇 | D. | 乙烷 |
1.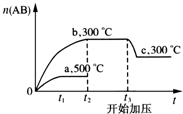 可逆反应:A2(?)+B2(?)?2AB(?),当温度和压强改变时n(AB)的变化如图,下列叙述正确的是( )
可逆反应:A2(?)+B2(?)?2AB(?),当温度和压强改变时n(AB)的变化如图,下列叙述正确的是( )
 可逆反应:A2(?)+B2(?)?2AB(?),当温度和压强改变时n(AB)的变化如图,下列叙述正确的是( )
可逆反应:A2(?)+B2(?)?2AB(?),当温度和压强改变时n(AB)的变化如图,下列叙述正确的是( )| A. | A2、B2及AB均为气体,△H<0 | |
| B. | AB为气体,A2、B2至少有一种为非气体,△H<0 | |
| C. | AB为气体,A2、B2有一种为非气体,△H>0 | |
| D. | AB为固体,A2、B2有一种为非气体,△H>0 |
11.下列分子中所有原子都满足最外层为8个电子结构的是( )
| A. | BCl3 | B. | NCl3 | C. | H2S | D. | BeCl2 |
15.已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,其中aq代表稀溶液,以下四个反应方程式中,反应热△H=-57.3kJ/mol的是( )
| A. | H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l) | |
| B. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═BaSO4(s)+H2O(l) | |
| C. | HCl(aq)+NaOH(aq)═NaCl(aq)+H2O(l) | |
| D. | HCl(aq)+NH3•H2O(aq)═NH4Cl(aq)+H2O(l) |

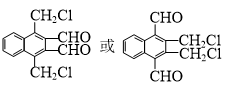 .
.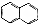 )的衍生物,且取代基都在同一个苯环上;
)的衍生物,且取代基都在同一个苯环上;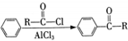 (R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和
(R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和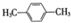 为原料制备
为原料制备 的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示: