题目内容
1.有关下列图象的说法不正确的是( )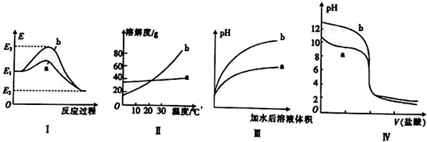
| A. | 图Ⅰ表法某放热反应过程中的能量变化,则曲线a可表示加入催化剂的反应 | |
| B. | 图Ⅱ表示两种盐的溶解度曲线,在较高温度下制得浓溶液再冷却结晶,过滤、洗涤、干燥可得纯净的固体a | |
| C. | 图Ⅲ表示相同pH的盐酸和醋酸分别用水稀释,则曲线a为醋酸 | |
| D. | 图Ⅳ表示相同物质的量浓度的NaOH溶液和氨水分别用盐酸滴定的曲线,则曲线a表示氨水 |
分析 A.图象中反应物能量高于生成物,反应为放热反应,曲线a表示降低了反应的活化能最后达到相同的平衡状态;
B.a溶解度随温度变化不大,冷却热宝和溶液的方法不能得到a晶体;
C.根据盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,故a应为醋酸稀释时的pH值变化曲线,b为盐酸;
D.相同物质的量浓度的NaOH溶液和氨水,溶液pH氢氧化钠大b为NaOH溶液,a为一水合氨溶液.
解答 解:A.图象中反应物能量高于生成物,反应为放热反应,曲线a表示降低了反应的活化能最后达到相同的平衡状态,说明a为加入催化剂改变反应速率,故A正确;
B.图Ⅱ表示两种盐的溶解度曲线,b溶解度随温度变化大,在较高温度下制得浓溶液再冷却结晶,过滤、洗涤、干燥可得纯净的固体b,故B错误;
C.用水稀释pH相同的盐酸和醋酸,醋酸是弱电解质存在电离平衡,溶液pH增大小;所以b表示盐酸,a表示醋酸,故C正确;
D.相同物质的量浓度的NaOH溶液和氨水,图象中的PH分析可知溶液pH氢氧化钠大b为NaOH溶液,a为一水合氨溶液,故D正确;
故选B.
点评 本题考查了化学平衡影响因素的分析判断,催化剂对速率和平衡的影响分析,弱电解质稀释电离平衡的分析判断,物质溶解度随温度变化的特征,题目难度中等.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
11.下列分子中所有原子都满足最外层为8个电子结构的是( )
| A. | BCl3 | B. | NCl3 | C. | H2S | D. | BeCl2 |
9.下列实验方案中,能达到相应实验目的是( )
| A | B | C | D | |
| 方案 | 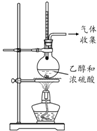 |  | 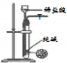 | 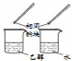 |
| 目的 | 利用乙醇的消去反应制取乙烯 | 蒸发NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量纯净的CO2气体 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
| A. | A | B. | B | C. | C | D. | D |
6.根据下列实验现象所得出的结论不正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机层呈橙色 | 氧化性:Cl2>KBrO3 |
| B | 向KNO3和KOH混合溶液中加入铝粉并加热,将湿润的红色石蕊试纸放在试管口 | 试纸变为蓝色 | NO3-被还原为NH3 |
| C | 向0.1mol•L-1的Na2CO3溶液中加入两滴酚酞,溶液显浅红色,微热. | 红色加深 | 盐类水解是吸热反应 |
| D | 将0.1mol•L-1的MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol•L-1的CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| A. | A | B. | B | C. | C | D. | D |
13.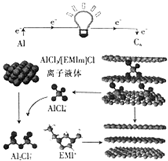 英国《自然》杂志近期报道了一种用泡沫石墨烯(Cn)作正极材料的新型铝离子电池,其放电时的工作原理如图所示.下列说法不正确的是( )
英国《自然》杂志近期报道了一种用泡沫石墨烯(Cn)作正极材料的新型铝离子电池,其放电时的工作原理如图所示.下列说法不正确的是( )
 英国《自然》杂志近期报道了一种用泡沫石墨烯(Cn)作正极材料的新型铝离子电池,其放电时的工作原理如图所示.下列说法不正确的是( )
英国《自然》杂志近期报道了一种用泡沫石墨烯(Cn)作正极材料的新型铝离子电池,其放电时的工作原理如图所示.下列说法不正确的是( )| A. | 放电时,若外电路中转移1mol电子,则负极质量减少9g | |
| B. | 充电时,石墨烯作阳极 | |
| C. | 充电时,阴极的电极反应式为AlCl4-+3e-═Al+4Cl- | |
| D. | 放电时,正极的电极反应式为Cn(AlCl4-)+e-═Cn+AlCl4- |
10.下列解释事实的方程式不正确的是( )
| A. | 明矾净水:Al3++3H2O?Al(OH)3(胶体)+3H+ | |
| B. | 用稀HNO3清洗试管内壁上的银:Ag+2H++NO3-═Ag++NO2↑+H2O | |
| C. | 实验室盛装NaOH溶液的试剂瓶不能用玻璃塞:SiO2+2OH-═SiO32-+H2O | |
| D. | 焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 |


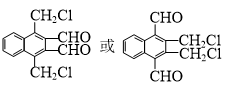 .
.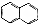 )的衍生物,且取代基都在同一个苯环上;
)的衍生物,且取代基都在同一个苯环上;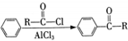 (R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和
(R为烃基).根据已有知识并结合相关信息,写出以ClCH2CH2CH2Cl和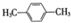 为原料制备
为原料制备 的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如图所示: