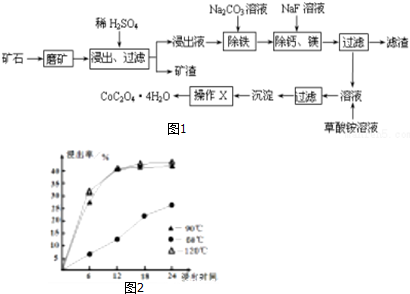
题目内容
3.H是一种香料,可用如图的设计方案合成.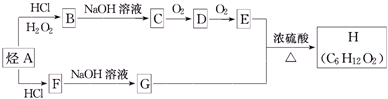
已知:①在一定条件下,有机物有下列转化关系:
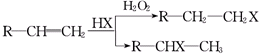 (X为卤素原子)
(X为卤素原子)②在不同的条件下,烃A和等物质的量HCl在不同的条件下发生加成反应,既可以生成只含有一个甲基的B,也可以生成含有两个甲基的F.
(1)烃A→B的化学反应方程CH3CH=CH2+HCl→CH3CH2CH2Cl.
(2)F→G的化学反应类型是取代反应.
(3)E+G→H的化学反应方程式为CH3CH2COOH+CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH2COOCH(CH3)2+H2O
(4)H有多种同分异构体,其中含有一个羧基,且其一氯代物有两种的同分异构体是
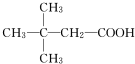 (用结构简式表示).
(用结构简式表示).
分析 由转化关系可知,E含有羧基、G含有-OH,且E、G含有相同的碳原子数目,故E与G发生酯化反应生成H,由H的分子式可知,E为CH3CH2COOH,F中含有2个甲基,则G为CH3CH(OH)CH3,逆推可得,F为CH3CHClCH3,D为CH3CH2CHO,C为CH3CH2CH2OH,B为CH3CH2CH2Cl,A为CH3CH=CH2,据此解答.
解答 解:由转化关系可知,E含有羧基、G含有-OH,且E、G含有相同的碳原子数目,故E与G发生酯化反应生成H,由H的分子式可知,E为CH3CH2COOH,F中含有2个甲基,则G为CH3CH(OH)CH3,逆推可得,F为CH3CHClCH3,D为CH3CH2CHO,C为CH3CH2CH2OH,B为CH3CH2CH2Cl,A为CH3CH=CH2,
(1)烃A→B的化学反应方程式是:CH3CH=CH2+HCl→CH3CH2CH2Cl,
故答案为:CH3CH=CH2+HCl→CH3CH2CH2Cl;
(2)F→G是CH3CHClCH3发生取代反应生成CH3CH(OH)CH3,
故答案为:取代反应;
(3)E+G→H的化学反应方程式为:CH3CH2COOH+CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH2COOCH(CH3)2+H2O,
故答案为:CH3CH2COOH+CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH2COOCH(CH3)2+H2O;
(4)H有多种同分异构体,其中含有一个羧基,且其一氯代物有两种的是 ,
,
故答案为: .
.
点评 本题考查有机物的推断、有机物的性质、同分异构体、有机反应类型等,难度不大,掌握官能团的性质越转化是关键,注意根据H的分子式利用逆推法进行推断.

练习册系列答案
相关题目
13.下列有关化学反应现象或化学原理的解释正确的是( )
| 选项 | 现象或反应 | 原理解释 |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有漂白性 |
| B | 合成氨反应需在高温条件下进行 | 该反应为吸热反应 |
| C | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是被蒸馏物质的沸点 |
| D | 2CO=2C+O2在任何条件下均不能自发进行 | 该反应△H>0,△S<0 |
| A. | A | B. | B | C. | C | D. | D |
14.关于下列图示的说法中错误的是( )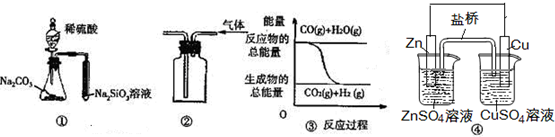

| A. | 图 ④中的装置可形成持续稳定的电流.将锌片浸入CuSO4溶液中发生的化学反应与图 ④中的原电池装置反应不相同 | |
| B. | 用图 ②所示实验装置排空气法收集H2气体 | |
| C. | 图 ③表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”为放热反应 | |
| D. | 用图 ①所示实验可比较硫、碳、硅三种元素的非金属性强弱 |
18.表是元素周期表一部分,列出了九种元素在周期表中的位置:
请用化学用语回答下列问题
(1)在上述元素中,非金属性最强的是F,在③~⑦元素中,原子半径最大的是Mg;
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式).写出①和④的最高价氧化物对应的水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
(3)用电子式表示③和⑨形成的化合物的形成过程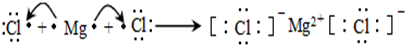 .
.
(4)表中元素①和⑦可以形成一种淡黄色物质X,写出X的电子式: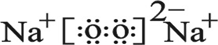 ,该物质所含化学键类型离子键和共价键,0.1mol X与水反应转移电子数为:0.1NA.
,该物质所含化学键类型离子键和共价键,0.1mol X与水反应转移电子数为:0.1NA.
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 3 | ① | ③ | ④ | ⑨ | ||||
| 4 | ② |
(1)在上述元素中,非金属性最强的是F,在③~⑦元素中,原子半径最大的是Mg;
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是HClO4(填物质化学式).写出①和④的最高价氧化物对应的水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
(3)用电子式表示③和⑨形成的化合物的形成过程
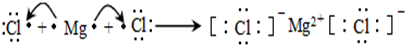 .
.(4)表中元素①和⑦可以形成一种淡黄色物质X,写出X的电子式:
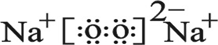 ,该物质所含化学键类型离子键和共价键,0.1mol X与水反应转移电子数为:0.1NA.
,该物质所含化学键类型离子键和共价键,0.1mol X与水反应转移电子数为:0.1NA.
8.硼有两种天然同位素${\;}_{5}^{10}$B、${\;}_{5}^{11}$B,假设硼元素的相对原子质量为10.2,则${\;}_{5}^{11}$B的质量分数为( )
| A. | 20% | B. | 80% | C. | 78.4% | D. | 21.6% |
12.下列实验操作能达到预期实验目的是( )
| A. | 为检验卤代烃中的卤原子,先加入NaOH溶液加热,再加入AgNO3溶液观察颜色变化 | |
| B. | 为制取乙酸乙酯,将稀H2SO4和乙醇、乙酸混合加热,放出的蒸气通入盛有NaOH溶液的试管中 | |
| C. | 为检验醛基的存在,先向试管中加入2mL2%的NaOH溶液和数滴CuSO4溶液,再加乙醛,煮沸 | |
| D. | 为制取乙烯,将稀H2SO4和乙醇混合加热 |
11.下列分子中所有原子都满足最外层为8个电子结构的是( )
| A. | BCl3 | B. | NCl3 | C. | H2S | D. | BeCl2 |
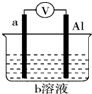 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.