题目内容
下列反应符合图图示的是( )
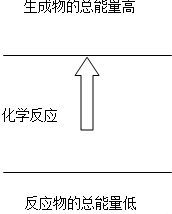

| A、铝片与盐酸的反应 |
| B、盐酸与NaOH溶液的中和反应 |
| C、Ba(OH)2?8H2O与NH4Cl晶体的反应 |
| D、甲烷在氧气中的燃烧 |
考点:吸热反应和放热反应
专题:化学反应中的能量变化
分析:当反应物的总能量小于生成物的总能量时,反应是吸热反应.
根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答:
解:根据图示:反应物的总能量小于生成物的总能量,所以表示吸热反应.
A.铝片与盐酸的反应为放热反应,故A错误;
B.酸碱中和反应为放热反应,故B错误;
C.Ba(OH)2?8H2O与NH4Cl晶体的反应为吸热反应,故C正确;
D.甲烷在氧气中的燃烧为放热反应,故D错误.
故选C.
A.铝片与盐酸的反应为放热反应,故A错误;
B.酸碱中和反应为放热反应,故B错误;
C.Ba(OH)2?8H2O与NH4Cl晶体的反应为吸热反应,故C正确;
D.甲烷在氧气中的燃烧为放热反应,故D错误.
故选C.
点评:本题考查化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.

练习册系列答案
相关题目
下列说法中,正确的是( )
| A、1 mol任何气体的体积都约为22.4 L |
| B、标准状况下,含有6.02×1023个原子的气体的体积都约是22.4 L |
| C、常温常压下,2 g氢气所含有的分子数约为6.02×1023 |
| D、标准状况下,1 mol SiO2所占有的体积约为22.4 L |
 如图是甲、乙两种固体物质的溶解度曲线,下列叙述不正确的是( )
如图是甲、乙两种固体物质的溶解度曲线,下列叙述不正确的是( )| A、甲、乙两种物质的溶解度随着温度的升高而增大 |
| B、在t1℃时,100g甲的饱和溶液中含有10g甲物质 |
| C、在t2℃时,甲、乙两种物质的溶解度相等 |
| D、在t3℃时,甲饱和溶液溶质的质量分数大于乙饱和溶液溶质的质量分数 |
下列反应中属于氧化还原反应的是( )
| A、CO2+2NaOH═Na2CO3+H2O |
| B、CuO+2HCl═CuCl2+H2O |
| C、CaCO3+2HCl═CaCl2+H2O+CO2↑ |
| D、2Na+2H2O═2NaOH+H2↑ |
X、Y、Z三种非金属,原子最外层电子数相等.等物质的量的单质X2、Y2、Z2分别与足量钠反应时放热,反应热分别为Q1、Q2、Q3,且Q1>Q2>Q3,下列判断一定正确的是( )
| A、气态氢化物的沸点HX>HY>HZ |
| B、若能形成最高价氧化物,则其水化物酸性HXO4>HYO4>HZO4 |
| C、气态氢化物的稳定性HX<HY<HZ |
| D、原子半径X>Y>Z |
某锂电池的工作原理为LiMOx+Cn=Li1-yMOx+LiyCn(其中M为:Co、Mn、Ni).Li的化合物始终为+1甲,某一极的电极反应式为:LiMOx-ye-=Li1-yMOx+yLi+,则下列说法不正确的是( )
| A、该电池工作时是把化学能转化为电能 |
| B、LiMOx是该电池的负极 |
| C、其正极反应方程式为:LiyCn-ye-=Cn+yLi+ |
| D、手机往往使用锂电池的原因之一为锂是最轻的金属 |
