题目内容
某锂电池的工作原理为LiMOx+Cn=Li1-yMOx+LiyCn(其中M为:Co、Mn、Ni).Li的化合物始终为+1甲,某一极的电极反应式为:LiMOx-ye-=Li1-yMOx+yLi+,则下列说法不正确的是( )
| A、该电池工作时是把化学能转化为电能 |
| B、LiMOx是该电池的负极 |
| C、其正极反应方程式为:LiyCn-ye-=Cn+yLi+ |
| D、手机往往使用锂电池的原因之一为锂是最轻的金属 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据电池总反应为LiMOx+Cn=Li1-yMOx+LiyCn可知,负极失电子,负极反应式为:LiMOx-ye-=Li1-yMOx+yLi+,正极得电子,正极反应式为Cn+yLi++ye-=LiyCn,据此分析.
解答:
解:A、该装置为原电池,工作时是把化学能转化为电能,故A正确;
B、原电池中负极失电子,LiMOx失电子做负极,故B正确;
C、该电池中Cn在正极上得电子,则正极反应式为Cn+yLi++ye-=LiyCn,故C错误;
D、Li的相对原子质量为7,是最轻的金属,则手机往往使用锂电池的原因之一为锂是最轻的金属,故D正确;
故选C.
B、原电池中负极失电子,LiMOx失电子做负极,故B正确;
C、该电池中Cn在正极上得电子,则正极反应式为Cn+yLi++ye-=LiyCn,故C错误;
D、Li的相对原子质量为7,是最轻的金属,则手机往往使用锂电池的原因之一为锂是最轻的金属,故D正确;
故选C.
点评:本题考查了原电池原理的应用,侧重于正负极的判断和电极方程式的书写,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
下列叙述完全正确的一组是( )
①一定条件下,气体的摩尔体积为22.4L
②标准状况下,将锌加入到盐酸中放出nLH2,则转移电子数为
③O.1mol?L-1的100mL Na2S04溶液中,含有的离子数约为O.03NA
④常温常压下,32gO2所含的原子数为2NA
⑤标准状况下,22.4L水中所含分子数为NA
⑥将含1mol FeCl3的饱和氯化铁溶液逐滴加入沸水制备得到红褐色氢氧化铁胶体,其中含NA个Fe(OH)3胶体粒子.
①一定条件下,气体的摩尔体积为22.4L
②标准状况下,将锌加入到盐酸中放出nLH2,则转移电子数为
| nNA |
| 11.2 |
③O.1mol?L-1的100mL Na2S04溶液中,含有的离子数约为O.03NA
④常温常压下,32gO2所含的原子数为2NA
⑤标准状况下,22.4L水中所含分子数为NA
⑥将含1mol FeCl3的饱和氯化铁溶液逐滴加入沸水制备得到红褐色氢氧化铁胶体,其中含NA个Fe(OH)3胶体粒子.
| A、①②③④⑤ | B、②④⑤ |
| C、②③④ | D、①②④⑥ |
下列反应符合图图示的是( )
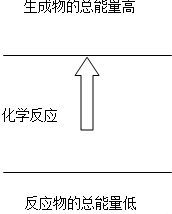

| A、铝片与盐酸的反应 |
| B、盐酸与NaOH溶液的中和反应 |
| C、Ba(OH)2?8H2O与NH4Cl晶体的反应 |
| D、甲烷在氧气中的燃烧 |
下列关于苯的叙述正确的是( )


A、反应①常温下能进行,其有机产物为 |
| B、反应②不发生,但是仍有分层现象,紫色层在下层 |
| C、反应③为加成反应,产物是三硝基甲苯 |
| D、反应④中1mol苯最多与3mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |
下列有关说法正确的是( )
| A、H2O2中只含有极性共价键 |
| B、可用酸性高锰酸钾溶液来区别甲烷和乙烯 |
| C、物质的化学反应与体系的能量变化不一定同时发生 |
| D、铜锌稀硫酸原电池工作时,电子沿外电路从铜电极流向锌电极 |
某氧化还原反应中有反应物和生成物共六种:NO、FeSO4、Fe(NO3)3、H2O、HNO3和Fe2(SO4)3.该氧化还原反应中的还原产物是( )
| A、NO |
| B、FeSO4 |
| C、Fe(NO3)3 |
| D、Fe2(SO4)3 |
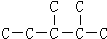 ,此烷烃的一溴代物有
,此烷烃的一溴代物有