题目内容

原电池是将
考点:原电池和电解池的工作原理
专题:电化学专题
分析:原电池是一种将化学能转化为电能的装置;原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应;较活泼金属做负极,负极发生失电子的氧化反应,不活泼金属作正极,正极上发生得电子的还原反应.
解答:
解:原电池是一种将化学能转化为电能的装置;
A中没有形成闭合不能形成原电池,B中Fe、Ag、硫酸构成的原电池,C中酒精不是电解质溶液不能形成原电池,D中没有两个活泼性不同的电极不能构成原电池,
Fe、Ag、硫酸构成的原电池中活泼金属Fe做负极,负极发生失电子的氧化反应,电极反应为Fe-2e-═Fe2+,金属铜做正极,发生银离子得电子得还原反应,则正极反应为:2Ag++2e-═2Ag,总反应式为Fe+2Ag+-═2Ag+Fe2+.
故答案为:化学;电;B;氧化;Fe-2e-═Fe2+;2Ag++2e-═2Ag;Fe+2Ag+-═2Ag+Fe2+.
A中没有形成闭合不能形成原电池,B中Fe、Ag、硫酸构成的原电池,C中酒精不是电解质溶液不能形成原电池,D中没有两个活泼性不同的电极不能构成原电池,
Fe、Ag、硫酸构成的原电池中活泼金属Fe做负极,负极发生失电子的氧化反应,电极反应为Fe-2e-═Fe2+,金属铜做正极,发生银离子得电子得还原反应,则正极反应为:2Ag++2e-═2Ag,总反应式为Fe+2Ag+-═2Ag+Fe2+.
故答案为:化学;电;B;氧化;Fe-2e-═Fe2+;2Ag++2e-═2Ag;Fe+2Ag+-═2Ag+Fe2+.
点评:本题考查学生原电池的工作原理知识,涉及正负极的判断及电极方程式的书写等,难度不大.

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目
下列反应符合图图示的是( )
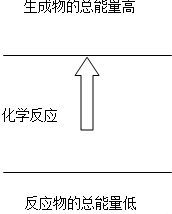

| A、铝片与盐酸的反应 |
| B、盐酸与NaOH溶液的中和反应 |
| C、Ba(OH)2?8H2O与NH4Cl晶体的反应 |
| D、甲烷在氧气中的燃烧 |
某氧化还原反应中有反应物和生成物共六种:NO、FeSO4、Fe(NO3)3、H2O、HNO3和Fe2(SO4)3.该氧化还原反应中的还原产物是( )
| A、NO |
| B、FeSO4 |
| C、Fe(NO3)3 |
| D、Fe2(SO4)3 |
从淡化海水中提取溴的流程如图所示,下列有关说法错误的是( )


| A、X为SO2气体,也可将SO2换成Na2SO3 |
| B、设备Y为蒸馏塔 |
| C、在提取溴的过程中一定有Br-被氧化 |
| D、工业上每获得1mol Br2,需要消耗Cl2的体积最多为22.4L(标准状态下) |
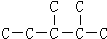 ,此烷烃的一溴代物有
,此烷烃的一溴代物有