题目内容
X、Y、Z三种非金属,原子最外层电子数相等.等物质的量的单质X2、Y2、Z2分别与足量钠反应时放热,反应热分别为Q1、Q2、Q3,且Q1>Q2>Q3,下列判断一定正确的是( )
| A、气态氢化物的沸点HX>HY>HZ |
| B、若能形成最高价氧化物,则其水化物酸性HXO4>HYO4>HZO4 |
| C、气态氢化物的稳定性HX<HY<HZ |
| D、原子半径X>Y>Z |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X、Y、Z三种非金属,原子最外层电子数相等,则这三种元素位于同一主族,等物质的量的单质X2、Y2、Z2分别与足量钠反应时放热,反应热分别为Q1、Q2、Q3,且Q1>Q2>Q3,元素的非金属性越强,其单质与钠反应放出的热量越多,所以非金属性强弱顺序是X>Y>Z,
A.氢化物的沸点与其相对分子质量成正比,但含有氢键的氢化物沸点最高;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.元素的非金属性越强,其氢化物越稳定;
D.同一主族元素,元素的非金属性随着原子序数增大而减弱,元素原子半径随着原子序数增大而增大.
A.氢化物的沸点与其相对分子质量成正比,但含有氢键的氢化物沸点最高;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.元素的非金属性越强,其氢化物越稳定;
D.同一主族元素,元素的非金属性随着原子序数增大而减弱,元素原子半径随着原子序数增大而增大.
解答:
解:X、Y、Z三种非金属,原子最外层电子数相等,则这三种元素位于同一主族,等物质的量的单质X2、Y2、Z2分别与足量钠反应时放热,反应热分别为Q1、Q2、Q3,且Q1>Q2>Q3,元素的非金属性越强,其单质与钠反应放出的热量越多,所以非金属性强弱顺序是X>Y>Z,
A.如果HX含有氢键,则氢化物的沸点HX>HZ>HY,如果HX中不含氢键,则氢化物的沸点HX<HY<HZ,故A错误;
B.元素非金属性X>Y>Z,若能形成最高价氧化物,则其水化物酸性HXO4>HYO4>HZO4,故B正确;
C.元素非金属性X>Y>Z,则气态氢化物的稳定性HX>HY>HZ,故C错误;
D.同一主族元素,元素的非金属性随着原子序数增大而减弱,元素原子半径随着原子序数增大而增大,原子序数大小顺序是X<Y<Z,则原子半径X<Y<Z,故D错误;
故选B.
A.如果HX含有氢键,则氢化物的沸点HX>HZ>HY,如果HX中不含氢键,则氢化物的沸点HX<HY<HZ,故A错误;
B.元素非金属性X>Y>Z,若能形成最高价氧化物,则其水化物酸性HXO4>HYO4>HZO4,故B正确;
C.元素非金属性X>Y>Z,则气态氢化物的稳定性HX>HY>HZ,故C错误;
D.同一主族元素,元素的非金属性随着原子序数增大而减弱,元素原子半径随着原子序数增大而增大,原子序数大小顺序是X<Y<Z,则原子半径X<Y<Z,故D错误;
故选B.
点评:本题考查了原子结构和元素周期律,涉及最高价含氧酸酸性强弱判断、氢化物的沸点及稳定性判断等知识点,根据非金属的非金属性强弱与氢化物的稳定性、最高价含氧酸强弱的关系即可解答,注意:HX中要考虑是否含有氢键,为易错点.

练习册系列答案
相关题目
X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-离子具有相同的电子层结构.下列说法不正确的是( )
| A、原子最外层电子数:Z>X>Y |
| B、氢化物的稳定性:Z>X |
| C、离子半径:X2->Y+>Z- |
| D、原子序数:X>Y>Z |
一般硫粉含有S(单斜)和S(正交)两种同素异形体.已知常温下:

S(单斜)+O2(g)=SO2(g)△H1=-297.16kJ/mol;
S(正交)+O2(g)=SO2(g)△H2=-296.83kJ/mol.
下列说法错误的是( )

S(单斜)+O2(g)=SO2(g)△H1=-297.16kJ/mol;
S(正交)+O2(g)=SO2(g)△H2=-296.83kJ/mol.
下列说法错误的是( )
| A、常温下正交硫比单斜硫稳定 |
| B、S(单斜)=S(正交)△H3=-0.33kJ/mol |
| C、单斜硫转变为正交硫的能量变化可用图表示 |
| D、S(g)+O2(g)=SO2(g)△H4,则△H4<-297.16kJ/mol |
某反应2A+3B═2C+D在四种不同条件下的反应速率如下,则反应速率最快的是( )
| A、v(A)=0.5 mol/(L?min) |
| B、v(B)=0.6 mo1(L?min) |
| C、v(C)=0.35 mol/(L?min) |
| D、v(D)=0.4 mol/(L?min) |
下列反应符合图图示的是( )
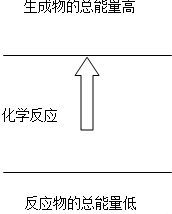

| A、铝片与盐酸的反应 |
| B、盐酸与NaOH溶液的中和反应 |
| C、Ba(OH)2?8H2O与NH4Cl晶体的反应 |
| D、甲烷在氧气中的燃烧 |
下列过程或现象中与盐类水解无关的是( )
| A、用纯碱溶液去油污 |
| B、久置的石灰水失效 |
| C、加热氯化铁溶液颜色变深 |
| D、浓硫化钠溶液有臭味 |
下列关于苯的叙述正确的是( )


A、反应①常温下能进行,其有机产物为 |
| B、反应②不发生,但是仍有分层现象,紫色层在下层 |
| C、反应③为加成反应,产物是三硝基甲苯 |
| D、反应④中1mol苯最多与3mol H2发生加成反应,是因为苯分子含有三个碳碳双键 |