题目内容
下列说法中,正确的是( )
| A、1 mol任何气体的体积都约为22.4 L |
| B、标准状况下,含有6.02×1023个原子的气体的体积都约是22.4 L |
| C、常温常压下,2 g氢气所含有的分子数约为6.02×1023 |
| D、标准状况下,1 mol SiO2所占有的体积约为22.4 L |
考点:气体摩尔体积
专题:计算题,化学用语专题
分析:A、温度压强不知不能确定去体积;
B、气体分子有的是双原子分子,有的是单原子分子,有的是多原子分子;
C、依据n=
=
计算;
D、二氧化硅不是气体.
B、气体分子有的是双原子分子,有的是单原子分子,有的是多原子分子;
C、依据n=
| m |
| M |
| N |
| NA |
D、二氧化硅不是气体.
解答:
解:A、温度压强不知不能确定去体积,标准状况1 mol任何气体的体积都约为22.4 L,故A错误;
B、气体分子有的是双原子分子,有的是单原子分子,有的是多原子分子,标准状况下,含有6.02×1023个分子的气体的体积都约是22.4 L,故B错误;
C、依据n=
=
计算,2 g氢气物质的量=
=1mol,所含有的分子数约为6.02×1023,故C正确;
D、二氧化硅不是气体,故D错误;
故选C.
B、气体分子有的是双原子分子,有的是单原子分子,有的是多原子分子,标准状况下,含有6.02×1023个分子的气体的体积都约是22.4 L,故B错误;
C、依据n=
| m |
| M |
| N |
| NA |
| 2g |
| 2g/mol |
D、二氧化硅不是气体,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,注意气体摩尔体积条件分析判断,物质结构理解应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
下列说法错误的是( )
| A、0.3 mol硝酸 |
| B、1.5 mol氧气 |
| C、1 mol氮 |
| D、0.5 mol氖 |
在一定温度下,向a L密闭容器中加入一定量A、B气体,发生如下反应:A2(g)+3B(g)?2C2 (g)+2D(g),可以作为反应达到平衡的标志是( )
| A、容器中总压强不随时间变化而变化 |
| B、单位时间内断裂一个A-A键,同时生成两个C-C键 |
| C、v正(B)=0.03mol/(L?s),v逆(D)=1.2mol/(L?min) |
| D、容器中气体的平均相对分子质量不随时间变化而变化 |
X、Y、Z均是短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-离子具有相同的电子层结构.下列说法不正确的是( )
| A、原子最外层电子数:Z>X>Y |
| B、氢化物的稳定性:Z>X |
| C、离子半径:X2->Y+>Z- |
| D、原子序数:X>Y>Z |
某小组为研究电化学原理,设计如图装置,下列叙述不正确的是( )


| A、a和b不连接时,铁片上会有金属铜析出 |
| B、a和b用导线连接时,铜片上发生的反应为:Cu2++2e-═Cu |
| C、无论a和b是否连接,均会产生气泡,a和b不连接时产生气泡的速率比a和b用导线连接时的速率快 |
| D、无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
下列叙述完全正确的一组是( )
①一定条件下,气体的摩尔体积为22.4L
②标准状况下,将锌加入到盐酸中放出nLH2,则转移电子数为
③O.1mol?L-1的100mL Na2S04溶液中,含有的离子数约为O.03NA
④常温常压下,32gO2所含的原子数为2NA
⑤标准状况下,22.4L水中所含分子数为NA
⑥将含1mol FeCl3的饱和氯化铁溶液逐滴加入沸水制备得到红褐色氢氧化铁胶体,其中含NA个Fe(OH)3胶体粒子.
①一定条件下,气体的摩尔体积为22.4L
②标准状况下,将锌加入到盐酸中放出nLH2,则转移电子数为
| nNA |
| 11.2 |
③O.1mol?L-1的100mL Na2S04溶液中,含有的离子数约为O.03NA
④常温常压下,32gO2所含的原子数为2NA
⑤标准状况下,22.4L水中所含分子数为NA
⑥将含1mol FeCl3的饱和氯化铁溶液逐滴加入沸水制备得到红褐色氢氧化铁胶体,其中含NA个Fe(OH)3胶体粒子.
| A、①②③④⑤ | B、②④⑤ |
| C、②③④ | D、①②④⑥ |
下列反应符合图图示的是( )
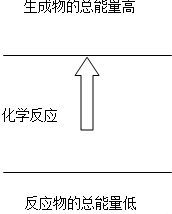

| A、铝片与盐酸的反应 |
| B、盐酸与NaOH溶液的中和反应 |
| C、Ba(OH)2?8H2O与NH4Cl晶体的反应 |
| D、甲烷在氧气中的燃烧 |
 A、B、C、D、E、F六种物质有如下转化关系(部分生成物已略去).已知A、C、F均为钠盐,其中固体C受热分解可生成固体F、气体B和水,气体单质E的相对分子质量比B大27.请回答下列问题:
A、B、C、D、E、F六种物质有如下转化关系(部分生成物已略去).已知A、C、F均为钠盐,其中固体C受热分解可生成固体F、气体B和水,气体单质E的相对分子质量比B大27.请回答下列问题: