题目内容
下列反应中属于氧化还原反应的是( )
| A、CO2+2NaOH═Na2CO3+H2O |
| B、CuO+2HCl═CuCl2+H2O |
| C、CaCO3+2HCl═CaCl2+H2O+CO2↑ |
| D、2Na+2H2O═2NaOH+H2↑ |
考点:氧化还原反应
专题:氧化还原反应专题
分析:属于氧化还原反应,说明该反应中有电子转移,其特征是有元素化合价升降,据此分析解答.
解答:
解:A.该反应中各元素化合价不变,所以不属于氧化还原反应,但属于化合反应,故A错误;
B.该反应中各元素化合价不变,所以不属于氧化还原反应,故B错误;
C.该反应中各元素化合价不变,所以不属于氧化还原反应,但属于复分解反应,故C错误;
D.该反应中Na元素化合价由0价变为+1价、H元素化合价由+1价变为0价,所以属于氧化还原反应,还属于置换反应,故D正确;
故选D.
B.该反应中各元素化合价不变,所以不属于氧化还原反应,故B错误;
C.该反应中各元素化合价不变,所以不属于氧化还原反应,但属于复分解反应,故C错误;
D.该反应中Na元素化合价由0价变为+1价、H元素化合价由+1价变为0价,所以属于氧化还原反应,还属于置换反应,故D正确;
故选D.
点评:本题考查了氧化还原反应的判断,根据元素化合价是否变化来分析解答,知道氧化还原反应和四大反应类型的关系,题目难度不大.

练习册系列答案
相关题目
在一定温度下,向a L密闭容器中加入一定量A、B气体,发生如下反应:A2(g)+3B(g)?2C2 (g)+2D(g),可以作为反应达到平衡的标志是( )
| A、容器中总压强不随时间变化而变化 |
| B、单位时间内断裂一个A-A键,同时生成两个C-C键 |
| C、v正(B)=0.03mol/(L?s),v逆(D)=1.2mol/(L?min) |
| D、容器中气体的平均相对分子质量不随时间变化而变化 |
下列电离方程式中,书写正确的是( )
| A、KClO3=K++Cl-+3O2- |
| B、NaHCO3=Na++H++CO32ˉ |
| C、NaHSO4=Na++H++SO42ˉ |
| D、FeCl3=Fe3++Clˉ |
一定浓度的H2SO4溶液中,逐滴加入BaCl2溶液,直到SO42-全部沉淀为止,已知沉淀的质量与原来H2SO4溶液的质量相等,则原来H2SO4溶液的浓度为( )
| A、29.6% |
| B、42.1% |
| C、12.4mol/L |
| D、6.22mol/L |
溴与氯同属“卤族”元素,其单质在性质上具有很大的相似性,但Cl2比Br2的活泼性强,下面是根据氯气的性质,对溴单质性质的预测,其中不正确的是( )
| A、溴单质溶于水得到溴水 |
| B、溴单质与烧碱溶液不反应 |
| C、溴单质与氢气反应的产物为溴化氢,其水溶液具有强酸性 |
| D、溴离子可以用硝酸酸化过的AgNO3溶液来检验 |
下列反应符合图图示的是( )
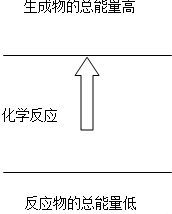

| A、铝片与盐酸的反应 |
| B、盐酸与NaOH溶液的中和反应 |
| C、Ba(OH)2?8H2O与NH4Cl晶体的反应 |
| D、甲烷在氧气中的燃烧 |
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色(已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀),则下列叙述正确的是( )
| A、原溶液中的Br-一定被氧化 |
| B、通入氯气之后原溶液中的Fe2+一定被氧化 |
| C、溶液中一定不存在Fe2+ |
| D、若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3 溶液,能产生黄色沉淀 |
下列有关说法正确的是( )
| A、H2O2中只含有极性共价键 |
| B、可用酸性高锰酸钾溶液来区别甲烷和乙烯 |
| C、物质的化学反应与体系的能量变化不一定同时发生 |
| D、铜锌稀硫酸原电池工作时,电子沿外电路从铜电极流向锌电极 |