题目内容
3.在一密闭气缸中,用一不漏气可滑动的活塞隔开,左边充有N2,右边充有H2和O2的混合气体,在20℃时,将右边混合气体点燃,反应后冷却到原来温度,若活塞原来离气缸左端的距离为总长的$\frac{1}{4}$,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为( )| A. | 4:5 | B. | 5:4 | C. | 2:7 | D. | 2:1 |
分析 左室中氮气的物质的量不变,令开始氮气的物质的量为1mol,左右两室压强相同,体积之比等于物质的量之比,据此计算开始右室中氢气与氧气的物质的量,反应后左右体积相等,则右室剩余气体的物质的量为1mol,该气体可能是氧气或氢气,根据差量法计算,原混合气体中氢气、氧气的物质的量,进而计算体积比.
解答 解:左室中氮气的物质的量不变,令开始氮气的物质的量为1mol,左右两室压强相同,体积之比等于物质的量之比,故开始右室中氢气与氧气的物质的量为1mol×$\frac{\frac{3}{4}}{\frac{1}{4}}$=3mol,反应后左右体积相等,则右室剩余气体的物质的量为1mol,则:
2H2+O2=2H2O 气体物质的量减少△n
2 1 3
$\frac{4}{3}$mol $\frac{2}{3}$mol 3mol-1mol=2mol
若剩余气体为氢气,则原混合气体中氧气为$\frac{2}{3}$mol,则氢气为3mol-$\frac{2}{3}$mol=$\frac{7}{3}$mol,H2和O2的体积比为$\frac{7}{3}$mol:$\frac{2}{3}$mol=7:2,
若剩余气体是氧气,则原混合气体中氢气为 $\frac{4}{3}$mol,则氢气为3mol-$\frac{4}{3}$mol=$\frac{5}{3}$mol,H2和O2的体积比为 $\frac{4}{3}$mol:$\frac{5}{3}$mol=4:5,
故选A.
点评 本题考查化学方程式的计算,题目难度中等,根据左室氮气的物质的量利用体积判断右室气体的物质的量是关键,试题培养了学生的化学计算能力.

 步步高达标卷系列答案
步步高达标卷系列答案| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
| ① | ② | |
| A | 无明显现象 | 只有AgBr沉淀生成 |
| B | 生成淡黄色沉淀 | AgCl和AgBr沉淀都有,但AgCl沉淀更多 |
| C | 无明显现象 | AgCl和AgBr沉淀都有,但AgCl沉淀更多 |
| D | 生成黄色沉淀 | AgCl和AgBr沉淀都有,但AgBr沉淀更多 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 将0.1mol氨充分溶解在1L水中 | |
| B. | 将10g质量分数为98%的硫酸与990g水混合 | |
| C. | 将10mL•1mol•L-1的盐酸与90mL水充分混合 | |
| D. | 将25.0g胆矾(CuSO4•5H2O)溶于水配成1L溶液 |
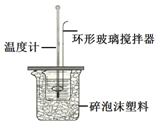 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)Ⅰ.某实验小组用0.50mol/L NaOH溶液和0.50mol/L盐酸溶液进行中和热的测定,实验中要配制250mL0.50mol/L的NaOH溶液,则需要NaOH固体质量为5.0g;
Ⅱ.(1)该图中环形玻璃搅拌棒的作用是使酸与碱混合均匀,充分反应;
(2)取50mL NaOH溶液和50mL盐酸溶液进行实验,实验数据如表:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| HCl | NaOH | ||
| 1 | 26.1 | 26.1 | 29.3 |
| 2 | 25.9 | 25.9 | 29.0 |
| 3 | 26.3 | 26.3 | 29.6 |
(近似认为0.50mol/L NaOH溶液和0.50mol/L盐酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c0=4.2J/(g•℃),Q=-c0×m×△t)
(3)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是实验装置保温、隔热效果差等.
| A. | 在浓度大的盐酸中反应产生的气体多 | |
| B. | 一样多 | |
| C. | 在浓度小的盐酸中反应产生的气体多 | |
| D. | 由反应的剧烈程度决定 |
(1)图1是生产亚氯酸钠的工艺流程图:

①写出Ⅱ的化学方程式ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②操作Ⅰ包含C、E、过滤、洗涤
A.蒸发浓缩 B.蒸馏 C.减压蒸发浓缩 D.加热蒸发 E.冷却结晶 F.分液
(2)上述离子隔膜电解池的原理如图2,c、d为电极,ef、gh为离子交换膜,两膜中间的Na+和SO42-可通过隔膜,而两端隔室中离子被阻挡不能进入中间的隔室.
①c电极可以为B;
A.铁电极 B.石墨电极 C.铁或者石墨均可
②ef膜为阴离子交换膜(填“阳”或“阴”);
(3)亚氯酸钠漂白织物时真正起作用的是HClO2,表是25℃几种酸的电离平衡常数:
| 酸 | HClO2 | H2CO3 | HClO |
| Ka | 1×10-2 | K1=4.3×10-7、K2=5.6×10-11 | 3×10-8 |
a.SO2 b.CO2 c.稀硫酸 d.盐酸 e.HClO.
| A. | 碘酒可使蛋白质变性,故能消毒杀菌 | |
| B. | 天然氨基酸能溶于强酸或强碱溶液,在两性化合物 | |
| C. | 常温下,强酸和弱酸的浓度相同时,强酸中水的电离程度比弱酸中的大 | |
| D. | 船舶外壳装上锌块,是牺牲阳极的阴极保护法进行防腐 |