题目内容
14.已知在25°C时,Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.0×10-13,将AgC1与AgBr的饱和溶液等体积混合,现象为①,再加入足量浓AgNO3溶液,发生的反应为②,则下列选项中符合上述事实的是( )| ① | ② | |
| A | 无明显现象 | 只有AgBr沉淀生成 |
| B | 生成淡黄色沉淀 | AgCl和AgBr沉淀都有,但AgCl沉淀更多 |
| C | 无明显现象 | AgCl和AgBr沉淀都有,但AgCl沉淀更多 |
| D | 生成黄色沉淀 | AgCl和AgBr沉淀都有,但AgBr沉淀更多 |
| A. | A | B. | B | C. | C | D. | D |
分析 由Ksp可知,AgC1与AgBr的饱和溶液等体积混合,先生成淡黄色沉淀,c(Cl-)>c(Br-),再加入足量浓AgNO3溶液,二种沉淀均生成,以此来解答.
解答 解:由Ksp可知,AgC1与AgBr的饱和溶液等体积混合,先生成淡黄色沉淀,c(Cl-)>c(Br-),再加入足量浓AgNO3溶液,二种沉淀均生成,且AgCl沉淀更多,
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp小的先沉淀及离子浓度与Ksp的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
11.下列实验操作中,错误的是( )
| A. | 倾倒液体时试剂瓶标签面向手心. | |
| B. | 玻璃棒蘸取溶液滴到放在表面皿上湿润的pH试纸上. | |
| C. | 用HCl溶液洗涤并灼烧铂丝后,再进行焰色反应. | |
| D. | KOH溶液保存在带磨口玻璃塞的试剂瓶中. |
12.由乙烷和乙醇蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为( )
| A. | 15% | B. | 21% | C. | 25% | D. | 无法确定 |
6.将Na投入FeCl3溶液中,可观察到的现象是( )
| A. | 生成白色沉淀、有气泡产生 | B. | 生成红褐色沉淀、有气泡产生 | ||
| C. | 生成黑色沉淀,有气泡产生 | D. | 无明显现象 |
3.在一密闭气缸中,用一不漏气可滑动的活塞隔开,左边充有N2,右边充有H2和O2的混合气体,在20℃时,将右边混合气体点燃,反应后冷却到原来温度,若活塞原来离气缸左端的距离为总长的$\frac{1}{4}$,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为( )
| A. | 4:5 | B. | 5:4 | C. | 2:7 | D. | 2:1 |
4.下列有关实验原理或操作正确的是( )
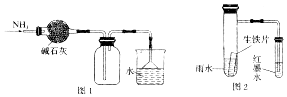

| A. | 图1所示的装置可用于干燥、收集并吸收多余的氨气 | |
| B. | 用广泛pH试纸测得0.1mol•L-1NaClO溶液的pH值约为12 | |
| C. | 用蒸发溶剂的方法将10%的Ca(HCO3)2溶液变为20%的Ca(HCO3)2溶液 | |
| D. | 用图2的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀 |
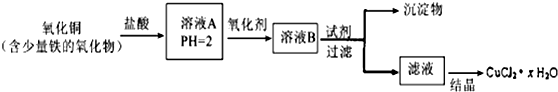
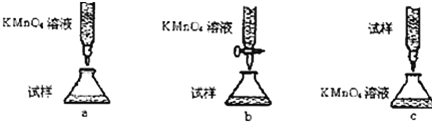
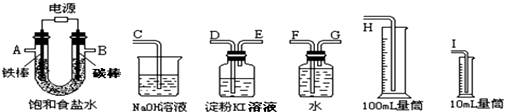
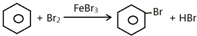 ;
;
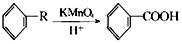 从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.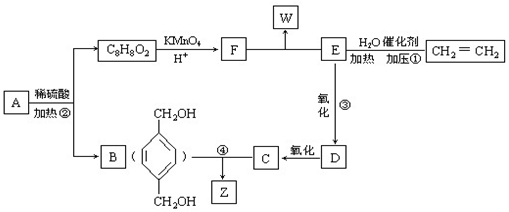
 +2CH3COOH$?_{△}^{浓硫酸}$
+2CH3COOH$?_{△}^{浓硫酸}$ +2H2O.
+2H2O.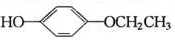 、
、 、
、 、
、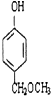 任意2个 (任写两种)
任意2个 (任写两种)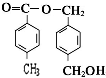 .
.