题目内容
13.废旧无汞碱性锌锰电池可用于制造隐形战机的机身涂料MnxZn(1-x)Fe2O4,该电池工作反应原理为Zn+2MnO2+2H2O$\frac{\underline{\;KOH\;}}{\;}$2MnO(OH)+Zn(OH)2.某化学小组利用废电池制涂料的工艺如下:A.浸取:将去除表面塑料的旧电池加入水中浸取并过滤,滤液经操作a得KOH固体;
B.溶液:滤渣中加入过量稀硫酸和足量双氧水,至不再出现气泡时,过滤;
C.测成分:测步骤B中滤液成分,然后加入铁粉;
D.氧化:加入双氧水氯化;
E.调pH:滴加氨水调pH,经结晶处理得MnxZn(1-x)Fe2O4.
(1)浸取时的操作有AC.
A.拆解、粉碎旧电池 B.降低温度 C.搅拌 D.加压
(2)操作a为蒸发至有大量晶体产生时停止加热.
(3)溶渣时生成Mn2+的主要离子方程式为2MnO(OH)+H2O2+4H+═2Mn2++O2↑+4H2O.
(4)若步骤C测得滤液中金属离子组成为:c(Mn2+)+c(Zn2+)=0.8mol/L,c(Fe2+)=0.1mol/L.若滤液体积为lm3,要合成MnxZn(1-x)Fe2O4,需加入Fe粉质量为84kg(忽略体积变化).
(5)氧化时,因为分解所需双氧水的量比理论值大得多.其原因可能是①温度过高;②生成Fe3+起催化作用促使双氧水分解.
(6)最后一步结晶时,处理不当易生成MnFe2O4和ZnFe2O4.要制得MnxZn(1-x)Fe2O4,最后一步结晶时需注意均匀结晶(或搅拌均匀).
(7)某小组构想用ZnSO4、MnSO4溶液为原料,以Fe作电极用电解法经过一系列步骤制得MnxZn(1-x)Fe2O4,则开始电解时阳极反应式为Fe-2e-=Fe2+.
分析 (1)浸取时要将旧电池拆解、粉碎入水中搅拌浸取;
(2)滤液经操作蒸发、结晶得到固体物质;
(3)MnO(OH)中的锰元素是+3价变+2价得电子,所以过氧化氢失电子,生成氧气;
(4)n(Mn2+)+n(Zn2+)=0.8mol/L×1000L=800mol,已有铁元素0.1mol/L×1000L=100mol,由电荷守恒可知MnxZn(1-x)Fe2O4中Fe2O42-800mol,其中铁元素的物质的量为800mol×2=1600mol;
(5)从双氧水分解所常用的催化剂的角度分析另外一种可能;
(6)结晶时,处理不当易生成MnFe2O4和ZnFe2O4的原因是没有搅拌均匀;
(7)Fe是活性电极,活性电极作阳极,自身失去电子.
解答 解:(1)浸取时要将旧电池拆解、粉碎入水中搅拌浸取,所以浸取时的操作有拆解、粉碎和搅拌,并不需要改变温度、压强,
故选:AC;
(2)滤液经操作蒸发结晶得到KOH固体,所以滤液经蒸发至有大量晶体产生时停止加热,
故答案为:蒸发至有大量晶体产生时停止加热;
(3)MnO(OH)中的锰元素是+3价变+2价得电子,所以过氧化氢失电子,生成氧气,反应的化学方程式为:2MnO(OH)+H2O2+4H+═2Mn2++O2↑+4H2O,
故答案为:2MnO(OH)+H2O2+4H+═2Mn2++O2↑+4H2O;
(4)n(Mn2+)+n(Zn2+)=0.8mol/L×1000L=800mol,由电荷守恒可知MnxZn(1-x)Fe2O4中Fe2O42-800mol,其中铁元素的物质的量为800mol×2=1600mol,已有铁元素0.1mol/L×1000L=100mol,还需加入铁的物质的量为1600mol-100mol=1500mol,质量为1500mol×56g/mol=84000g=84kg,
故答案为:84;
(5)氧化时,因为分解所需双氧水的量比理论值大得多,除温度过高外,另一种可能就是双氧水在Fe3+起催化作用分解,
故答案为:生成Fe3+起催化作用促使双氧水分解;
(6)最后一步结晶时,要搅拌均匀,使MnxZn(1-x)Fe2O4均匀结晶,防止生成MnFe2O4和ZnFe2O4,
故答案为:均匀结晶(或搅拌均匀);
(7)Fe是活性电极,活性电极作阳极,自身失去电子,阳极电极反应式为Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+.
点评 本题考查无机化学工艺、物质的分离和提纯实验操作、电化学原理和计算,综合性较强,侧重于实验能力、计算能力、理论应用能力的考查,题目难度较大.

 名校课堂系列答案
名校课堂系列答案| A. | 4:5 | B. | 5:4 | C. | 2:7 | D. | 2:1 |
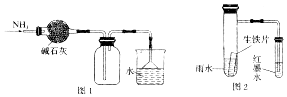
| A. | 图1所示的装置可用于干燥、收集并吸收多余的氨气 | |
| B. | 用广泛pH试纸测得0.1mol•L-1NaClO溶液的pH值约为12 | |
| C. | 用蒸发溶剂的方法将10%的Ca(HCO3)2溶液变为20%的Ca(HCO3)2溶液 | |
| D. | 用图2的装置可以验证生铁片在该雨水中是否会发生吸氧腐蚀 |
| A. | 10g质量分数为46%的乙醇水溶液中所含原子数目为0.6NA | |
| B. | 常温常压下,11.2L乙烯所含分子数目小于0.5NA | |
| C. | 常温常压下.4.4gN2O与CO2的混合气体中含的原子数目为0.3NA | |
| D. | 常温下,1molC5H12中含有共价键数为16NA |
| A. | 乙醇的结构简式为C2H6O | |
| B. | C3H6Cl2有5种同分异构体 | |
| C. | 乙酸溶于水可以电离,属于离子化合物 | |
| D. | 由苯乙烯生成聚苯乙烯塑料属于加聚反应 |
| A. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| B. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| C. | W的气态氢化物比X的稳定 | |
| D. | WX2与ZY2中的化学键类型相同 |
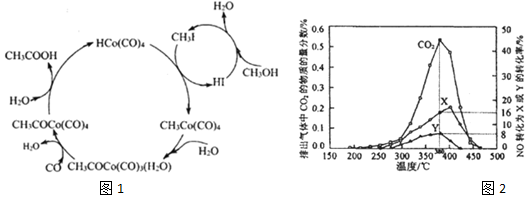
(1)CoO是一种油漆添加剂,可通过反应①②制备.
①2Co(s)+O2(g)═2CoO(s)△H1=akJ•mol-1
②2CoCO3(s)═CoO(s)+CO2 (g)△H2=akJ•mol-1
则反应2Co(s)+O2(g)+2CO2(g)═2CoO3(s) 的△H=(a-2b)kJ•mol-1
(2)某锂电池的电解质可传导Li+,电池反应式为:LiC6+CoO2?C6+LiCoO2
①电池放电时,负极的电极反应式为,Li+向正极移动(填“正极”或“负极“).
②一种回收电极中Co元素的方法是:将LiCoO2与H2O2、H2SO4反应生成CoSO4.该反应的化学方程式为2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+4H2O+O2↑
(3)BASF高压法制备醋酸采用钴碘催化循环过程如图1所示,该循环的总反应方程式为CO+CH3OH→CH3COOH(反应条件无需列出)
(4)某含钴催化剂可同时催化去除柴油车尾气中的碳烟(C)和NOx.不同温度下,将10mol模拟尾气(成分如图2所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如表
| 模拟尾气 | 气体 | 碳烟 | ||
| NO | O2 | He | ||
| 物质的量分数或物质的量 | 0.25% | 5% | 94.75% | a mol |
②实验过程中采用NO模拟NOx,而不采用NO2的原因是NO较NO2稳定,NO2气体中存在N2O4,不便于定量测定.
| A. | 相同温度下,Ksp(AgI)>Ksp(AgCl) | |
| B. | 由于AgCl与AgI的饱和水溶液几乎都不导电说明这两种物质均为非电解质 | |
| C. | 分别用等体积的蒸馏水和0.01 mol/L KI溶液洗涤AgI沉淀,用水洗涤沉淀损失量大 | |
| D. | 将AgCl与AgI的饱和溶液等体积混合后,再加入足量浓AgNO3溶液,只有AgI沉淀生成 |
| A. | 火山喷发 | |
| B. | 自然界中游离态硫缓慢氧化 | |
| C. | 煤、石油等含硫燃料的大量燃烧、硫矿石的冶炼及硫酸工业等产生的工业废气 | |
| D. | 汽车尾气 |