题目内容
18.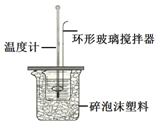 测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)
测定稀盐酸和稀氢氧化钠中和热的实验装置如图所示.(中和热:在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热)Ⅰ.某实验小组用0.50mol/L NaOH溶液和0.50mol/L盐酸溶液进行中和热的测定,实验中要配制250mL0.50mol/L的NaOH溶液,则需要NaOH固体质量为5.0g;
Ⅱ.(1)该图中环形玻璃搅拌棒的作用是使酸与碱混合均匀,充分反应;
(2)取50mL NaOH溶液和50mL盐酸溶液进行实验,实验数据如表:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| HCl | NaOH | ||
| 1 | 26.1 | 26.1 | 29.3 |
| 2 | 25.9 | 25.9 | 29.0 |
| 3 | 26.3 | 26.3 | 29.6 |
(近似认为0.50mol/L NaOH溶液和0.50mol/L盐酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c0=4.2J/(g•℃),Q=-c0×m×△t)
(3)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是实验装置保温、隔热效果差等.
分析 Ⅰ.根据公式m=nM=cVM来计算氢氧化钠的质量;
Ⅱ.(1)环形玻璃搅拌棒通过搅拌使酸与碱混合均匀;
(2)先判断温度差的有效性求出温度差平均值,然后根据Q=m•c•△T计算反应放出的热量,最后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
(3)根据测量原理:先根据Q=m•c•△T计算反应放出的热量,最后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热.
解答 解:Ⅰ.(1)需要称量NaOH固体m=nM=cVM=0.5mol/L×0.25L×40g/mol=5.0g,故答案为:5.0g;
Ⅱ.(1)该图中环形玻璃搅拌棒的作用是使酸与碱混合均匀,充分反应,故答案为:使酸与碱混合均匀,充分反应;
(2)3次温度差分别为:3.2℃,3.1℃,3.3℃,3组数据都有效,温度差平均值=3.2℃;50mL NaOH溶液和50mL盐酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100ml×1g/ml=100g,温度变化的值为△T=3.2℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.2J/(g•℃)×3.2℃=1344J,即1.344KJ,所以实验测得的中和热△H=-$\frac{1.344KJ}{0.025mol}$=-53.8kJ/mol;
故答案为:1344J;-53.8 kJ/mol;
(3)装置保温、隔热效果差,温度差偏小,测得的热量偏小,中和热的数值偏小,故答案为:实验装置保温、隔热效果差等.
点评 本题主要考查中和热的测定,题目难度中等,涉及溶液的配制、反应热的计算,注意理解中和热的概念以及测定反应热的误差等问题,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
15. 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:
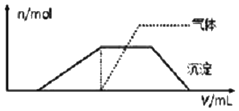
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.不能确定是否含有的阳离子有K+,要确定其存在可补充做实验的是肯定不存在的阴离子有ClO-、AlO2-
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为Cl2+2I-═I2+2Cl-;
②计算原溶液中Cl-、Br-、I-的物质的量浓度之比为10:15:4.
 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | Fe3+、H+、NH4+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
(2)经检测,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的Cl2溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
②计算原溶液中Cl-、Br-、I-的物质的量浓度之比为10:15:4.
6.将Na投入FeCl3溶液中,可观察到的现象是( )
| A. | 生成白色沉淀、有气泡产生 | B. | 生成红褐色沉淀、有气泡产生 | ||
| C. | 生成黑色沉淀,有气泡产生 | D. | 无明显现象 |
3.在一密闭气缸中,用一不漏气可滑动的活塞隔开,左边充有N2,右边充有H2和O2的混合气体,在20℃时,将右边混合气体点燃,反应后冷却到原来温度,若活塞原来离气缸左端的距离为总长的$\frac{1}{4}$,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为( )
| A. | 4:5 | B. | 5:4 | C. | 2:7 | D. | 2:1 |
10.化学与生活密切相关,下列说法不正确的是( )
| A. | 禁止或少放烟花炮竹、绿色出行可缓解雾霾天气的形成 | |
| B. | 在制作腊肉或香肠时,可加入过量的亚硝酸钠以保持肉类新鲜 | |
| C. | “地沟油”禁止食用,但处理后可用来制肥皂和生物柴油 | |
| D. | 盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可降低土壤的碱性 |
7.化学在生产和生活中有着重要的作用,下列有关说法正确的是( )
| A. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| B. | 含磷污水是很好的肥料,可灌溉庄稼,能直接排放到自然界水体中 | |
| C. | 施用适量石灰乳可降低盐碱地(含较多NaCl、Na2CO3)的碱性 | |
| D. | 最理想的“原子经济”就是原子利用率为100% |
8.下列关于有机化合物的说法正确的是( )
| A. | 乙醇的结构简式为C2H6O | |
| B. | C3H6Cl2有5种同分异构体 | |
| C. | 乙酸溶于水可以电离,属于离子化合物 | |
| D. | 由苯乙烯生成聚苯乙烯塑料属于加聚反应 |
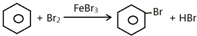 ;
;
 (填结构简式)
(填结构简式)