题目内容
8.在500g 0.2%的盐酸和500g 2%的盐酸中,分别加入2.3g钠,钠全部反应后,产生的气体( )| A. | 在浓度大的盐酸中反应产生的气体多 | |
| B. | 一样多 | |
| C. | 在浓度小的盐酸中反应产生的气体多 | |
| D. | 由反应的剧烈程度决定 |
分析 钠性质活泼,既能置换酸中的氢,也能置换水中的氢,在500g 0.2%的盐酸和500g 2%的盐酸中分别加入2.3g钠,钠的量不足,产生氢气的量取决于钠的量.
解答 解:金属Na的性质活泼,既能置换酸中的氢,也能置换出水中的氢,在500g 0.2%的盐酸和500g 2%的盐酸中,分别加入2.3gNa,金属Na会完全反应,两种条件下,钠完全反应,转移电子数相同,所以产生的氢气相同,
故选B.
点评 本题考查了化学方程式的计算,题目难度不大,明确钠的化学性质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
5. 在25℃下,稀释HA、HB两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积.下列说法正确的是( )
在25℃下,稀释HA、HB两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积.下列说法正确的是( )
 在25℃下,稀释HA、HB两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积.下列说法正确的是( )
在25℃下,稀释HA、HB两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积.下列说法正确的是( )| A. | lg$\frac{{V}_{2}}{{V}_{1}}$=6时,HA溶液的pH=8 | |
| B. | pH相同时,c(HA)>c(HB) | |
| C. | 曲线上a、b两点 $\frac{[{B}^{-}]}{[HB][O{H}^{-}]}$ 一定不相等 | |
| D. | 25℃时,NaA溶液的pH一定小于NaB溶液 |
16.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1mol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| C. | 1molCl2参加的氧化还原反应,反应过程中转移电子数都是2NA | |
| D. | 常温常压下,92gNO2和N2O4混合气体含有的原子数为6NA |
3.在一密闭气缸中,用一不漏气可滑动的活塞隔开,左边充有N2,右边充有H2和O2的混合气体,在20℃时,将右边混合气体点燃,反应后冷却到原来温度,若活塞原来离气缸左端的距离为总长的$\frac{1}{4}$,反应后静止于气缸的正中(忽略水蒸气),则原来H2和O2的体积比为( )
| A. | 4:5 | B. | 5:4 | C. | 2:7 | D. | 2:1 |
20.分子式为C5H12的烷烃一共有多少种同分异构体( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
18.短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体.下列说法正确的是( )
| A. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| B. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| C. | W的气态氢化物比X的稳定 | |
| D. | WX2与ZY2中的化学键类型相同 |
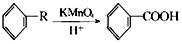 从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.
从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体.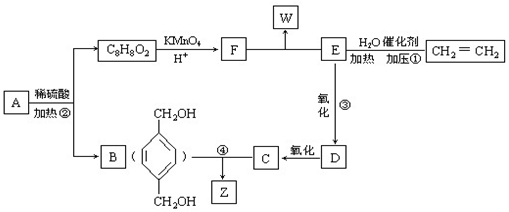
 +2CH3COOH$?_{△}^{浓硫酸}$
+2CH3COOH$?_{△}^{浓硫酸}$ +2H2O.
+2H2O.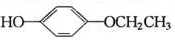 、
、 、
、 、
、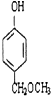 任意2个 (任写两种)
任意2个 (任写两种)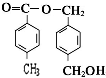 .
. NO2与SO2能发生反应:NO2+SO2?SO3+NO,某研究小组对此进行相关实验探究.
NO2与SO2能发生反应:NO2+SO2?SO3+NO,某研究小组对此进行相关实验探究.