题目内容
Na、Cu、O、Si、S、Cl是常见的六种元素.
(1)Na位于元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 .
(2)用“>”或“<”填空:
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体.在25℃、101kPa下,已知该反应每消耗1mol CuCl(s),放热44.4kJ,该反应的热化学方程式是 .
(4)ClO2常用水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2.写出该反应的离子方程式,并标出电子转移的方向和数目 .
(1)Na位于元素周期表第
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si | O2- | NaCl | H2SO4 |
(4)ClO2常用水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2.写出该反应的离子方程式,并标出电子转移的方向和数目
考点:真题集萃,元素周期表的结构及其应用,元素周期律的作用,氧化还原反应,热化学方程式
专题:氧化还原反应专题,元素周期律与元素周期表专题
分析:(1)Na元素位于元素周期表第三周期 第IA族;S的基态原子核外未成对电子处于3p轨道;Si原子核外电子基态排布式为1s22s22p63s23p2;
(2)同一周期元素的第一电离能随着原子序数的增大而增大;
核外电子排布相同的离子,核电荷数越大,离子半径越小;
一般来说,原子晶体(Si)的熔点高于离子晶体(NaCl)的熔点;
元素的非金属性越强,元素最高价氧化物的水化物的酸性越强;
(3)根据题干描述书写化学方程式,注意焓变与物质的量的对应关系、注明各物质的状态;
(4)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子.
(2)同一周期元素的第一电离能随着原子序数的增大而增大;
核外电子排布相同的离子,核电荷数越大,离子半径越小;
一般来说,原子晶体(Si)的熔点高于离子晶体(NaCl)的熔点;
元素的非金属性越强,元素最高价氧化物的水化物的酸性越强;
(3)根据题干描述书写化学方程式,注意焓变与物质的量的对应关系、注明各物质的状态;
(4)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子.
解答:
解:(1)Na元素位于元素周期表第三周期 第IA族;S的基态原子核外未成对电子处于3p轨道,共2个未成对电子;Si原子核外电子数为14,核外电子基态排布式为1s22s22p63s23p2,
故答案为:三;IA;2;1s22s22p63s23p2;
(2)同一周期元素,随着原子序数的增加,原子核对核外电子的吸引力增强,第一电离能增大,增大而增大,所以第一电离能:S>Si;核外电子排布相同的离子,核电荷数越大,离子半径越小,所以离子半径:O2->Na+;一般来说,原子晶体(Si)的熔点高于离子晶体(NaCl)的熔点,故熔点:Si>NaCl;元素的非金属性越强,元素最高价氧化物的水化物的酸性越强,因为非金属性Cl>S,所以酸性:HClO4>H2SO4;
故答案为:<;>;<;<;
(3)该反应每消耗1mol CuCl(s),放热44.4kJ,消耗4mol CuCl(s),则放热44.4kJ×4=177.6kJ,根据热化学方程式的书写方法,可以写出该反应的热化学方程式为4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol,
故答案为:4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol;
(4)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子,因此离子方程式、电子转移的方向和数目表示为 ,
,
故答案为: .
.
故答案为:三;IA;2;1s22s22p63s23p2;
(2)同一周期元素,随着原子序数的增加,原子核对核外电子的吸引力增强,第一电离能增大,增大而增大,所以第一电离能:S>Si;核外电子排布相同的离子,核电荷数越大,离子半径越小,所以离子半径:O2->Na+;一般来说,原子晶体(Si)的熔点高于离子晶体(NaCl)的熔点,故熔点:Si>NaCl;元素的非金属性越强,元素最高价氧化物的水化物的酸性越强,因为非金属性Cl>S,所以酸性:HClO4>H2SO4;
故答案为:<;>;<;<;
(3)该反应每消耗1mol CuCl(s),放热44.4kJ,消耗4mol CuCl(s),则放热44.4kJ×4=177.6kJ,根据热化学方程式的书写方法,可以写出该反应的热化学方程式为4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol,
故答案为:4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol;
(4)Cl2氧化NaClO2溶液制取ClO2,本身被还原为氯离子,1个氯气分子反应得到2个电子,因此离子方程式、电子转移的方向和数目表示为
 ,
,故答案为:
 .
.
点评:本题考查知识点较多,涉及原子结构和元素周期律、反应热的计算、离子方程式书写和氧化还原反转移电子数的计算和表示方法,为高考常见题型,侧重于学生计算能力、分析比较能力的培养.

练习册系列答案
相关题目
X、Y、Z、Q、W均为短周期元素,原子序数逐渐增大.X、Q同主族,Q元素的焰色反应为黄色;W的原子半径是同周期中最小的;X与Y、Z分别形成化合物甲、乙,甲、乙均由10电子分子构成,且能发生反应生成碱.下列说法不正确的是( )
| A、X的单质和Q的单质均可用电解法得到 |
| B、X与Z可形成同时含有极性键和非极性键的化合物 |
| C、Q与W形成的化合物熔化或溶于水时均可发生电离 |
| D、X、Y、Z三种元素形成的化合物一定能抑制水的电离 |
某溶液可能含有Cl-、SO42-、CO32-、OH-、NH4+、Al3+、Fe3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到 1.6g固体;向上述滤液中加足量BaCl2溶液,得到 6.99g不溶于盐酸的沉淀.下列关于原溶液的说法正确的是( )
| A、原溶液中至少存在3种离子 |
| B、原溶液中一定不存在的离子是:Cl-、CO32-、OH- |
| C、原溶液中可能存在的离子有:Cl-、Al3+和K+ |
| D、原溶液中一定存在的离子是:NH4+、Fe3+、SO42-和Cl-,且c(Cl-)≥0.2mol/L |
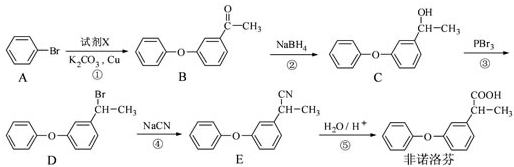
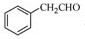 为原料制备
为原料制备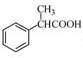 的合成路线流程图(无机试剂任用),合成路线路程图示例如下:
的合成路线流程图(无机试剂任用),合成路线路程图示例如下: 在密闭容器中,某反应在不同反应时间各物质的量的变化情况如右图所示(各物质均为气体).
在密闭容器中,某反应在不同反应时间各物质的量的变化情况如右图所示(各物质均为气体).