题目内容
如图是元素周期表的框架,请在表中①~⑩元素中回答问题
请用化学语言回答下列问题:
(1)在表中④、⑤、⑥三种元素的简单离子半径由大到小的顺序为 .
(2)其中⑤与⑦两元素的最高价氧化物的水化物反应的离子方程式为 .
(3)⑧与⑩两种元素非金属较强的是 ,请用一个离子方程式证明该结论 .
(4)①与③的两种单质可以在金属铂做电极时构成一种对环境友好的燃料电池,电解质为⑨的最高价氧化物的水化物,请书写出正极反应式 ,电池工作时阴离子定向移动到 极(填正或负).
(5)元素①与⑧的两种单质在一定条件下可反应生成一种化合物甲,已知下表中的数据是破坏1mol物质中的化学键所吸收的能量(kJ),则生成1mol甲时释放的能量为 kJ.
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||||
| ⑨ | ⑩ | ||||||||||||||||
(1)在表中④、⑤、⑥三种元素的简单离子半径由大到小的顺序为
(2)其中⑤与⑦两元素的最高价氧化物的水化物反应的离子方程式为
(3)⑧与⑩两种元素非金属较强的是
(4)①与③的两种单质可以在金属铂做电极时构成一种对环境友好的燃料电池,电解质为⑨的最高价氧化物的水化物,请书写出正极反应式
(5)元素①与⑧的两种单质在一定条件下可反应生成一种化合物甲,已知下表中的数据是破坏1mol物质中的化学键所吸收的能量(kJ),则生成1mol甲时释放的能量为
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,①为H、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Cl、⑨为K、⑩为Br,
(1)电子层结构相同,核电荷数越大离子半径越小;
(2)⑤与⑦两元素的最高价氧化物的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水;
(3)同主族自上而下元素非金属性减弱,利用卤素单质的相互置换反应可以证明元素非金属性强弱;
(4)正极发生还原反应,氧气在正极获得电子,碱性条件下生成氢氧根离子;电池工作时,电解质溶液中阴离子向负极移动;
(5)元素①与⑧的两种单质在一定条件下可反应生成一种化合物甲,发生反应:H2+Cl2=2HCl,形成化学键放出的能量-破坏化学键吸收的能量=反应放出的能量.
(1)电子层结构相同,核电荷数越大离子半径越小;
(2)⑤与⑦两元素的最高价氧化物的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水;
(3)同主族自上而下元素非金属性减弱,利用卤素单质的相互置换反应可以证明元素非金属性强弱;
(4)正极发生还原反应,氧气在正极获得电子,碱性条件下生成氢氧根离子;电池工作时,电解质溶液中阴离子向负极移动;
(5)元素①与⑧的两种单质在一定条件下可反应生成一种化合物甲,发生反应:H2+Cl2=2HCl,形成化学键放出的能量-破坏化学键吸收的能量=反应放出的能量.
解答:
解:由元素在周期表中的位置可知,①为H、②为N、③为O、④为F、⑤为Na、⑥为Mg、⑦为Al、⑧为Cl、⑨为K、⑩为Br,
(1)F-、Na+、Mg2+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径F->Na+>Mg2+,
故答案为:F->Na+>Mg2+;
(2)⑤与⑦两元素的最高价氧化物的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)同主族自上而下元素非金属性减弱,故非金属性Cl>Br,Cl2+2Br-=2Cl-+Br2可以证明元素Cl元素非金属更强,
故答案为:Cl;Cl2+2Br-=2Cl-+Br2;
(4)正极发生还原反应,氧气在正极获得电子,碱性条件下生成氢氧根离子,正极电极反应式为:O2+4e-+2H2O=4OH-,电池工作时,电解质溶液中阴离子向负极移动,
故答案为:O2+4e-+2H2O=4OH-;负;
(5)元素①与⑧的两种单质在一定条件下可反应生成一种化合物甲,发生反应:H2+Cl2=2HCl,生成1molHCl时释放的能量=432kJ-436kJ×0.5-243kJ×0.5=92.5kJ,
故答案为:92.5.
(1)F-、Na+、Mg2+离子电子层结构相同,核电荷数越大离子半径越小,故离子半径F->Na+>Mg2+,
故答案为:F->Na+>Mg2+;
(2)⑤与⑦两元素的最高价氧化物的水化物分别为氢氧化钠、氢氧化铝,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)同主族自上而下元素非金属性减弱,故非金属性Cl>Br,Cl2+2Br-=2Cl-+Br2可以证明元素Cl元素非金属更强,
故答案为:Cl;Cl2+2Br-=2Cl-+Br2;
(4)正极发生还原反应,氧气在正极获得电子,碱性条件下生成氢氧根离子,正极电极反应式为:O2+4e-+2H2O=4OH-,电池工作时,电解质溶液中阴离子向负极移动,
故答案为:O2+4e-+2H2O=4OH-;负;
(5)元素①与⑧的两种单质在一定条件下可反应生成一种化合物甲,发生反应:H2+Cl2=2HCl,生成1molHCl时释放的能量=432kJ-436kJ×0.5-243kJ×0.5=92.5kJ,
故答案为:92.5.
点评:本题考查元素周期表与元素周期律综合应用,难度中等,注意理解化学键与反应能量变化关系.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列有关实验的叙述正确的是( )
| A、用浓硝酸做试剂比较铁和铜的金属活动性 |
| B、用干燥洁净的玻璃棒蘸取氯水滴在干燥PH试纸上,测定氯水的PH |
| C、向两只分别装有碳酸钠和碳酸氢钠固体的试管中各加几滴水,前者温度降低,后者温度升高 |
| D、欲检验Br-的存在,可在溶液中先加入氯水,再加入CCl4,振荡、静置,观察下层溶液是否出现橙红色 |
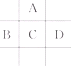 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,请回答下列问题:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同,请回答下列问题: