题目内容
某溶液可能含有Cl-、SO42-、CO32-、OH-、NH4+、Al3+、Fe3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到 1.6g固体;向上述滤液中加足量BaCl2溶液,得到 6.99g不溶于盐酸的沉淀.下列关于原溶液的说法正确的是( )
| A、原溶液中至少存在3种离子 |
| B、原溶液中一定不存在的离子是:Cl-、CO32-、OH- |
| C、原溶液中可能存在的离子有:Cl-、Al3+和K+ |
| D、原溶液中一定存在的离子是:NH4+、Fe3+、SO42-和Cl-,且c(Cl-)≥0.2mol/L |
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵离子;
红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,一定没有CO32-;
6.99g不溶于盐酸的沉淀,硫酸钡沉淀,物质的量为:0.03mol;
根据以上数据推算存在离子,根据电荷守恒推算氯离子的存在及数据.
红褐色沉淀是氢氧化铁,1.6g固体为三氧化二铁,可知一定有Fe3+,一定没有CO32-;
6.99g不溶于盐酸的沉淀,硫酸钡沉淀,物质的量为:0.03mol;
根据以上数据推算存在离子,根据电荷守恒推算氯离子的存在及数据.
解答:
解:由于加入过量NaOH溶液,加热,得到0.02mol气体,说明一定有NH4+,且物质的量为0.02mol;同时产生红褐色沉淀,说明一定有Fe3+,1.6g固体为氧化铁,物质的量为0.01mol,故有0.02molFe3+,一定没有CO32-和OH-;6.99g不溶于盐酸的沉淀为硫酸钡,一定有SO42-,物质的量为0.03mol;根据电荷守恒,一定有Cl-,至少 0.02mol×3+0.02-0.03mol×2=0.02mol,物质的量浓度至少
=0.2mol/L,
A.至少存在Cl-、SO42-、NH4+、Fe3+四种离子,故A错误;
B.原溶液中一定存在氯离子,一定不存在的离子是:CO32-、OH-,故B错误;
C.一定存在氯离子,可能存在的离子有:Al3+和K+,故C错误;
D.原溶液中一定存在的离子是:NH4+、Fe3+、SO42-和Cl-,且c(Cl-)≥0.2mol/L,故D正确,
故选D.
| 0.02 |
| 0.1 |
A.至少存在Cl-、SO42-、NH4+、Fe3+四种离子,故A错误;
B.原溶液中一定存在氯离子,一定不存在的离子是:CO32-、OH-,故B错误;
C.一定存在氯离子,可能存在的离子有:Al3+和K+,故C错误;
D.原溶液中一定存在的离子是:NH4+、Fe3+、SO42-和Cl-,且c(Cl-)≥0.2mol/L,故D正确,
故选D.
点评:本题考查离子共存知识,要认真阅读、分析题中数据,合理分析,特别是氯离子的推断,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法不正确的是( )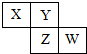
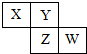
| A、Z元素的原子半径比Y元素的大 |
| B、若Y的最低化合价为-2,则W的最高正化合价为+6 |
| C、若Z的最高正化合价为+5,则X元素的化合物最多 |
| D、若HmZOn为强酸,则Y是活泼非金属元素 |
下列说法中,正确的是( )
| A、将NO2通入FeSO4溶液中不会有明显现象 |
| B、2L 0.5mol/L的盐酸和1L 0.5mol/L的硫酸PH相等 |
| C、饱和氯水中:c(H+)>c(Cl-)>c(HClO)>c(ClO-) |
| D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下反应的△H不相同 |
能正确表示下列反应的离子方程式是( )
| A、向氢氧化钠溶液中加入少量铝粉:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
| C、硫化钠溶液显碱性的原因:S2-+H2O═H2S+2OH- |
| D、向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
| X | Y | Z | |
| ① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
| ② | KOH溶液 | SiO2 | 浓盐酸 |
| ③ | O2 | N2 | H2 |
| ④ | FeCl3溶液 | Cu | 浓硝酸 |
| A、①③ | B、①④ | C、②④ | D、②③ |
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示.下列叙述正确的是( )| A、该反应进行到M点放出的热量大于进行到W点放出的热量 | ||
B、T2下,在0~t1时间内,v(Y)=
| ||
| C、M点的正反应速率V正大于N点的逆反应速率V逆 | ||
| D、M点时再加入一定量X,平衡后X的转化率减小 |
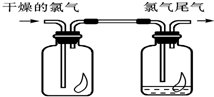 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是