题目内容
9.已知氢有(1H、2H、3H)三种同位素,氯有(35Cl、37Cl)两种同位素.用“精确的天平”分别称量1000个HCl分子,所得数据可能有( )| A. | 1种 | B. | 5种 | C. | 6种 | D. | 1000种 |
分析 根据氢原子有三种同位素、氯原子有两种同位素,从而可以得出所形成的HCl气体的种类,然后根据相对分子质量来分析.
解答 解:氢原子有三种同位素H、D、T,氯原子有两种同位素35Cl、37Cl,故氯化氢分子可能为:H35Cl、H37Cl、D35Cl、D37Cl、T35Cl、T37Cl,它们的相对分子质量分别为:36、38、37、39、38、40,故用一准确的仪器来分别测定1000个HCl分子的质量时,所得的数值可能有5种.
故选B.
点评 本题考查氢原子的三种同位素和氯原子的两种同位素的组合,难度不大,要注意平时的积累.

练习册系列答案
相关题目
20.下列有关电解质溶液的说法正确的是( )
| A. | 将NaHCO3、Na2SO3、FeCl3溶液蒸干灼烧均得不到原溶质 | |
| B. | 保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解 | |
| C. | 室温下,向0.1mol/L的CH3COOH溶液中加入少量水溶液显碱性的物质,CH3COOH的电离程度一定增大 | |
| D. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
17.某微粒的结构示意图为 ,当x-y=10时,该微粒为( )
,当x-y=10时,该微粒为( )
 ,当x-y=10时,该微粒为( )
,当x-y=10时,该微粒为( )| A. | 原子 | B. | 阳离子 | C. | 阴离子 | D. | 无法判断 |
4.如图是元素周期表的一部分,关于元素X、Y、Z的叙述不正确的是( )
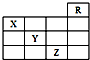

| A. | Z的原子序数比Y大19 | |
| B. | Z的单质常温下是深棕色液体,具有氧化性 | |
| C. | 同浓度的Y、Z的气态氢化物的水溶液的酸性Y>Z | |
| D. | X的气态氢化物与Y最高价氧化物对应的水化物的溶液能发生反应生成盐 |
14.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L 1mol•L-1的NaClO溶液含有ClO-的数目为NA | |
| B. | 22.4 L Cl2分别与足量的Cu、Fe完全反应转移电子数分别为2NA、3NA | |
| C. | 常温常压下,14g由N2和CO组成的混合气体含有的电子总数为7NA | |
| D. | 14.2g硫酸钠固体含有0.l NA个硫酸钠分子 |
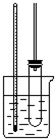 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下: 如图所示装置中,M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )
如图所示装置中,M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )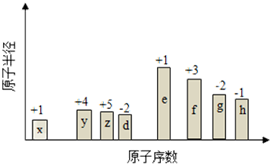 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题:
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题: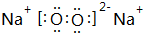 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.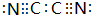 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.