题目内容
4.如图是元素周期表的一部分,关于元素X、Y、Z的叙述不正确的是( )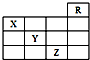
| A. | Z的原子序数比Y大19 | |
| B. | Z的单质常温下是深棕色液体,具有氧化性 | |
| C. | 同浓度的Y、Z的气态氢化物的水溶液的酸性Y>Z | |
| D. | X的气态氢化物与Y最高价氧化物对应的水化物的溶液能发生反应生成盐 |
分析 如图是元素周期表的一部分,则R为He、X为N元素、Y为S元素、Z为Br元素,
A.Z的原子序数为35,Y的原子序数为16;
B.常温下,溴单质为液体;
C.硫化氢为弱酸,HBr为强酸;
D.N的气态氢化物为氨气与最高价氧化物对应的水化物硝酸反应生成硝酸铵.
解答 解:如图是元素周期表的一部分,则R为He、X为N元素、Y为S元素、Z为Br元素,
A.Z的原子序数为35,Y的原子序数为16,所以Z的原子序数比Y大19,故A正确;
B.Z的单质为溴单质,常温下,溴单质为深红棕色液体,具有氧化性,故B正确;
C.硫化氢为弱酸,HBr为强酸,所以同浓度的Y、Z的气态氢化物的水溶液的酸性Y<Z,故C错误;
D.N的气态氢化物为氨气与最高价氧化物对应的水化物硝酸反应生成硝酸铵,硝酸铵属于离子化合物,故D正确.
故选C.
点评 本题考查位置、结构、性质及用途,把握元素的位置、元素及化合物的性质为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
14.有关钠的化合物的说法正确的是( )
| A. | Na2O和Na2O2都能与水反应生NaOH,它们都是碱性氧化物 | |
| B. | 向饱和NaCO3溶液中通人足量CO2,反应的离子方程式为CO2+H2O+CO32-=2HCO3- | |
| C. | 固体NaOH的潮解和Na2CO3•10H2O的风化均为物理变化 | |
| D. | NaCl可作为工业冶炼钠的原料,冶炼应在无水条件下进行 |
15. 已知溶液中:氧化性IO3->I2>SO32-.向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,下列说法正确的是( )
已知溶液中:氧化性IO3->I2>SO32-.向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,下列说法正确的是( )
 已知溶液中:氧化性IO3->I2>SO32-.向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,下列说法正确的是( )
已知溶液中:氧化性IO3->I2>SO32-.向含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,下列说法正确的是( )| A. | a点反应的还原剂是NaHSO3,被氧化的元素是碘元素 | |
| B. | b点反应的离子方程式是:3HSO3-+IO3-+3OH-═3SO42-+I-+3H2O | |
| C. | c点到d点的反应中共转移0.6mol电子 | |
| D. | 往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+2IO3-═I2+5SO42-+3H++H2O |
19.意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,下列说法正确的是( )
| A. | O4和O2互为同位素 | |
| B. | O4转化O2为物理变化 | |
| C. | 18O是氧元素的一种核素,它的中子数是8 | |
| D. | 同温同压下,等体积的O4气体和O2含有相同的分子数 |
9.已知氢有(1H、2H、3H)三种同位素,氯有(35Cl、37Cl)两种同位素.用“精确的天平”分别称量1000个HCl分子,所得数据可能有( )
| A. | 1种 | B. | 5种 | C. | 6种 | D. | 1000种 |
16.下列事实与浓硫酸表现出的性质(括号中)对应关系正确的是( )
| A. | 浓硫酸使胆矾晶体变白(脱水性) | |
| B. | 在加热条件下铜与浓硫酸反应(氧化性、酸性) | |
| C. | 蔗糖与浓硫酸反应中有海棉状的炭生成(吸水性) | |
| D. | 浓硫酸可用来干燥某些气体(不挥发性) |
13.某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下.
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“是”或“否”)?否.
(2)对实验3完成下列填空:
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
③电池总反应式:2Al+6HCl═2AlCl3+3H2↑.
(3)实验4中铝作负极还是正极负极,理由是在NaOH溶液中,活动性Al>Mg.写出铝电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中铝作正极的原因:Al在浓硝酸中发生钝化,Zn在浓硝酸中发生反应,被氧化,即在浓硝酸中活动性Zn>Al,Al是原电池的正极.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:另一个电极材料的活动性和电解质溶液的性质.
| 编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“是”或“否”)?否.
(2)对实验3完成下列填空:
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
③电池总反应式:2Al+6HCl═2AlCl3+3H2↑.
(3)实验4中铝作负极还是正极负极,理由是在NaOH溶液中,活动性Al>Mg.写出铝电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中铝作正极的原因:Al在浓硝酸中发生钝化,Zn在浓硝酸中发生反应,被氧化,即在浓硝酸中活动性Zn>Al,Al是原电池的正极.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:另一个电极材料的活动性和电解质溶液的性质.
14.下列各组离子在溶液中能大量共存是( )
| A. | Ca2+、HCO3-、Cl-、K+ | B. | Al3+、HCO3-、AlO2-、Na+ | ||
| C. | NH4+、SO42-、S2-、Fe2+ | D. | Fe3+、SCN-、CO32-、Na+ |