题目内容
18.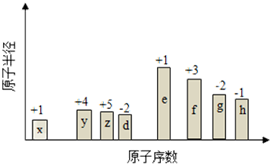 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题:
随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或 最低负价的变化如图所示. 根据判断出的元素回答问题:(1)f 在元素周期表的位置是第三周期ⅢA族.
(2)上述元素形成的简单阴、阳离子中,离子半径最大的是(用化学式表示,下同)S2-;在e、f、g、h 四种元素的最高价氧化物对应的水化物中的酸性最强的是HClO4.
(3)d、e能形成原子个数比为1:1的化合物,该化合物的电子式为
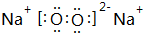 ,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.
,0.10mol该化合物与足量水反应时转移的电子数为6.02×1022.(4)气体分子(yz)2中y与z之间有三个共价键,则其电子式为
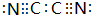 ,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.
,(yz)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是(CN)2+2NaOH=NaCN+NaCNO+H2O.
分析 从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,电子层越多离子半径越大;非金属性越强,最高价氧化物水化物的酸性越强;
(3)d、e能形成原子个数比为1:1的化合物为Na2O2;
(4)气体分子(CN)2中C与N之间有三个共价键,其结构式为N≡C-C≡N,性质与卤素类似,其与氢氧化钠溶液反应生成NaCN、NaCNO与水.
解答 解:从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族,
故答案为:第三周期ⅢA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故S2-的离子半径最大,
在e、f、g、h 四种元素中Cl元素非金属性最强,最高价氧化物对应的水化物中的酸性最强的是HClO4,
故答案为:S2-;HClO4;
(3)d、e能形成原子个数比为1:1的化合物为Na2O2,电子式为 ,与水发生反应:2Na2O2+2H2O=4NaOH+O2,反应中过氧化钠起氧化剂、还原剂,各占一半,0.1mol过氧化钠反应转移电子为0.1mol×$\frac{1}{2}$×2=0.1mol,即转移电子数目为6.02×1022,
,与水发生反应:2Na2O2+2H2O=4NaOH+O2,反应中过氧化钠起氧化剂、还原剂,各占一半,0.1mol过氧化钠反应转移电子为0.1mol×$\frac{1}{2}$×2=0.1mol,即转移电子数目为6.02×1022,
故答案为: ;6.02×1022;
;6.02×1022;
(4)气体分子(CN)2中C与N之间有三个共价键,其结构式为N≡C-C≡N,其电子式为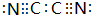 ,性质与卤素类似,其与氢氧化钠溶液反应生成NaCN、NaCNO与水,反应方程式为:(CN)2+2NaOH=NaCN+NaCNO+H2O,
,性质与卤素类似,其与氢氧化钠溶液反应生成NaCN、NaCNO与水,反应方程式为:(CN)2+2NaOH=NaCN+NaCNO+H2O,
故答案为: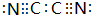 ;(CN)2+2NaOH=NaCN+NaCNO+H2O.
;(CN)2+2NaOH=NaCN+NaCNO+H2O.
点评 本题考查结构性质位置关系应用,根据化合价与原子半径推断元素是解题关键,注意对元素周期律的理解掌握.

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案| A. | pH=1的溶液:Fe2+、Ca2+、I-、Br- | |
| B. | Ag+、I-、K+、NO3- | |
| C. | 0.1mol/L 的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| D. | 与铝反应产生大量氢气的溶液:K+、Na+、[Al(OH)4]-、NO3- |
| A. | 1种 | B. | 5种 | C. | 6种 | D. | 1000种 |
| A. | 甲烷的二氯代物只有1种 | B. | 甲烷分子中4个C-H键的长度相同 | ||
| C. | 甲烷的一氯代物只有1种 | D. | 甲烷分子中4个C-H键的强度相同 |
| 编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“是”或“否”)?否.
(2)对实验3完成下列填空:
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
③电池总反应式:2Al+6HCl═2AlCl3+3H2↑.
(3)实验4中铝作负极还是正极负极,理由是在NaOH溶液中,活动性Al>Mg.写出铝电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中铝作正极的原因:Al在浓硝酸中发生钝化,Zn在浓硝酸中发生反应,被氧化,即在浓硝酸中活动性Zn>Al,Al是原电池的正极.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:另一个电极材料的活动性和电解质溶液的性质.
| A. | 原子半径:Y>Z>X | |
| B. | X与R的核电荷数相差18 | |
| C. | 气态氢化物稳定性:W>R | |
| D. | Y与Z两者最高价氧化物对应的水化物能相互反应 |
| A. | 使酚酞变红色的溶液中:Na+、AlO2-、SO42-、Cl- | |
| B. | 使紫色石蕊试纸变红的溶液中:K+、Fe2+、NO32-、Ca2- | |
| C. | 与Al反应能放出H2的溶液中:Na+、K+、NO3-、HCO3- | |
| D. | 显强酸性的溶液中:Na+、SO42-、ClO-、Cl- |