题目内容
14.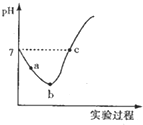 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验过程中可用pH试纸测定溶液的pH | |
| B. | a点的溶液中:C(H+)=c(Cl-)+c(HCl0)+c(OH-) | |
| C. | c 点所示溶液中;c(Na+)=2c(ClO )+c(HCIO) | |
| D. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 |
分析 整个过程发生的反应为Cl2+H2O═HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,根据溶液的酸碱性结合电荷守恒和物料守恒分析解答.
解答 解:A.溶液中含有次氯酸,具有漂白性,不能用pH试纸测pH,应选pH计,故A错误;
B.a点为氯水,溶液呈酸性,根据电荷守恒得:c(H+)=c(Cl-)+c(ClO-)+c(OH-),故B错误;
C.c点溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(Cl-)+c(Cl0-)+c(OH-),所以c(Na+)=c(Cl-)+c(ClO-),根据物料守恒得c(Cl-)=c(ClO-)+c(HClO),所以c(Na+)=c(HClO)+2c(ClO-),故C正确;
D.由a点到b点的过程是氯气的溶解平衡Cl2+H2O?H++Cl-+HClO向右进行的过程,酸性逐渐增强,氢离子浓度逐渐增大,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$增大,故D错误;
故选C.
点评 本题综合考查氯气的性质,为高频考点,侧重于学生的分析能力的考查,注意理解溶液中的溶质及其性质是解本题关键,根据物料守恒得c(Cl-)=c(ClO-)+c(HClO)为易错点,题目难度中等.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
4.足量的镁条分别在体积相同的①O2、②N2、③CO2充分燃烧,所得固体的质量由大到小的正确顺序是( )
| A. | ①②③ | B. | ③②① | C. | ②①③ | D. | ②③① |
5.某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子.下列描述可能正确的是( )
| A. | 该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 | |
| B. | 该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 | |
| C. | 加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 加入适量氨水后,c(CH3COO-)会大于c(Na+)、c(NH4+)之和 |
2.下列溶液中有关物质的量浓度关系不正确的是( )
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| D. | 在浓度均为0.1 mol•L-1Na2CO3、NaHCO3、NH4Cl溶液中c(H+)分别为c1、c2、c3,则c3>c2>c1 |
9.向恒容密闭容器中投入一定量W气体,发生如下反应:4W(g)?Q(g)+xM(g),在一定条件下反应达到了平衡状态,再投入1 mol W(g)在相同条件下达到第二次平衡.下列有关W转化率的推断正确的是( )
| A. | 若x=4,则W的转化率增大 | B. | 若x=3,则W的转化率不变 | ||
| C. | 若W的转化率增大,则x一定等于1 | D. | 缺条件,无法判断 |
6.将如图所示实验装置的K闭合,下列判断不正确的是( )


| A. | 盐桥中的Cl-向甲池移动,滤纸上的SO42-向b移动 | |
| B. | 电子流动沿Zn→a,b→Cu的路径 | |
| C. | Cu电极上的反应为:Cu2++2e-═Cu,滤纸a点发生还原反应 | |
| D. | 片刻后,甲池中c(Zn2+)增大,可观察到滤纸b点变红色 |
4.下列解释事实的反应方程式正确的是( )
| A. | 亚硫酸钠水溶液显碱性:SO32-+2H2O?H2SO3+2OH- | |
| B. | SO2的水溶液显酸性:SO2+H2O?H2SO3?2H++SO32- | |
| C. | 燃煤时加入石灰石减少SO2排放:2CaCO3+2SO2+O2$\frac{\underline{\;高温\;}}{\;}$2CaSO4+2CO2 | |
| D. | 浓NaOH溶液处理少量二氧化硫:SO2+OH-═HSO3- |
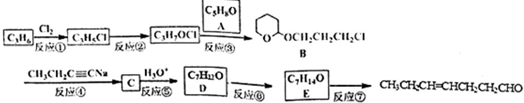
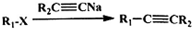
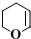 、CH3CH2C≡CCH2CH2CH2OH;
、CH3CH2C≡CCH2CH2CH2OH;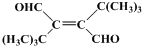 ;
;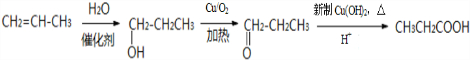 .
.