题目内容
4.足量的镁条分别在体积相同的①O2、②N2、③CO2充分燃烧,所得固体的质量由大到小的正确顺序是( )| A. | ①②③ | B. | ③②① | C. | ②①③ | D. | ②③① |
分析 据题意体积相同的①O2、②N2、③CO2即物质的量相等,可设物质的量为1mol,然后利用化学反应方程式分别计算反应后的固体产物的质量,比较大小可以得出答案.
解答 解:①1mol的氧气与镁完全反应生成物的质量为x,
2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO
1mol 80
1mol x
解得x=80克,
②设1mol的氮气中完全燃烧生成物的质量为y,
3Mg+N2 $\frac{\underline{\;点燃\;}}{\;}$ Mg3N2
1mol 100
1mol y
解得y=100克
③设1mol的二氧化碳中完全燃烧生成物的质量分别为z1和z2,则
2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$ 2MgO+C
1mol 80 12
1mol z1 z2
解得z1=80克,z2=12克,即镁在二氧化碳中完全燃烧生成物的质量为92克,
足量的镁条分别在体积相同的①O2、②N2、③CO2充分燃烧,所得固体的质量由大到小的正确顺序是为②>③>①.
故选D.
点评 本题考查学生利用化学反应方程式进行计算,学生应注意解答的规范化,难度不大.

练习册系列答案
相关题目
5.某氯原子的质量是a g,12C原子的质量是bg,用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 氯元素的相对原子质量为$\frac{12b}{a}$ | |
| B. | mg该氯原子的物质的量一定是$\frac{m}{(a{N}_{A})}$mol | |
| C. | 该氯元素的摩尔质量是aNA | |
| D. | ng该氯原子所含的电子数为$\frac{n}{a}$ |
6.CH2=CH2(g)+O2(g)═2 (g)△H=-106kJ•mol-1
(g)△H=-106kJ•mol-1
其反应机理如下:
①Ag+O2→AgO2 慢
②CH2=CH2+AgO2→ +AgO 快
+AgO 快
③CH2=CH2+6AgO→2CO2+2H2O+6Ag 快
下列有关该反应的说法正确的是( )
 (g)△H=-106kJ•mol-1
(g)△H=-106kJ•mol-1其反应机理如下:
①Ag+O2→AgO2 慢
②CH2=CH2+AgO2→
 +AgO 快
+AgO 快③CH2=CH2+6AgO→2CO2+2H2O+6Ag 快
下列有关该反应的说法正确的是( )
| A. | 反应的活化能等于106kJ•mol-1 | |
| B. | AgO2也是反应的催化剂 | |
| C. | 增大乙烯浓度能显著提高环氧乙烷的生成速率 | |
| D. | 理论上0.7mol乙烯参与反应最多可得到0.6mol环氧乙烷 |
9.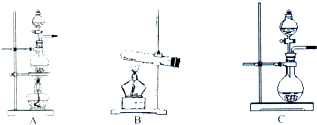 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:
(1)上述气体中,从反应中有无电子转移的角度看,明显不同于其他气体的是NH3,写出实验室制取该气体的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)根据表中所列实验原理,从如图装置中选择合适的发生装置,将其编号填入上表的空格中.
(3)若用上述制备O2的装置制备NH3,应选择的试剂为浓氨水和氢氧化钠(或生石灰等).
(4)在浓CaCl2溶液中通人NH3和CO2可以制得纳米级碳酸钙,制取时应先通入的气体是NH3,制取纳米级碳酸钙的化学方程式为CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl.试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级取少量样品和水混合形成分散系,用一束光从侧面照射,若出现光亮的通路,则证明样品是纳米级,否则不是.
(5)制备Cl2需用8mol•L-1的盐酸100mL,现用12mol•L-1的盐酸来配制.
①需要用量筒量取12mol•L-1的盐酸的体积为66.7mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为(填序号)ACFGH.
A.100mL量筒B.托盘天平C.玻璃棒D.50mL容量瓶
E.10mL量筒F.胶头滴管G.100mL烧杯H.100mL容量瓶
③下列实验操作中.不正确的是BC(填写标号).
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加人蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次.
 如表是实验室制备气体的有关内容:
如表是实验室制备气体的有关内容:| 编号 | 实验内容 | 实验原理 | 发生装置 |
| ① | 制氧气 | H2O2→O2 | C |
| ② | 制氨气 | NH4Cl→NH3 | B |
| ③ | 制氯气 | HCl→Cl2 | A或C |
(2)根据表中所列实验原理,从如图装置中选择合适的发生装置,将其编号填入上表的空格中.
(3)若用上述制备O2的装置制备NH3,应选择的试剂为浓氨水和氢氧化钠(或生石灰等).
(4)在浓CaCl2溶液中通人NH3和CO2可以制得纳米级碳酸钙,制取时应先通入的气体是NH3,制取纳米级碳酸钙的化学方程式为CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl.试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级取少量样品和水混合形成分散系,用一束光从侧面照射,若出现光亮的通路,则证明样品是纳米级,否则不是.
(5)制备Cl2需用8mol•L-1的盐酸100mL,现用12mol•L-1的盐酸来配制.
①需要用量筒量取12mol•L-1的盐酸的体积为66.7mL;
②实验室提供有如下仪器,为完成配制需要选择的仪器为(填序号)ACFGH.
A.100mL量筒B.托盘天平C.玻璃棒D.50mL容量瓶
E.10mL量筒F.胶头滴管G.100mL烧杯H.100mL容量瓶
③下列实验操作中.不正确的是BC(填写标号).
A.使用容量瓶前,检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,用量筒量取浓盐酸并沿玻璃棒倒入容量瓶中,缓慢加人蒸馏水到距离刻度线1~2cm处,改用胶头滴管滴加蒸馏水直到凹液面的最低点和刻度线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次.
16.关于苯的下列说法正确的是( )
| A. | 苯是1825年由俄国科学家门捷列夫发现的 | |
| B. | 苯与乙烯一样,是很重要的化工原料,可作消毒剂、有机溶剂、洗涤剂 | |
| C. | 苯的分子式中碳原子远没有饱和,因此能使溴水和高锰酸钾褪色 | |
| D. | 苯环上的碳碳键是一种介于单键和双键的独特的键,苯既能发生取代反应也能发生加成反应 |
14.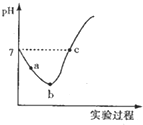 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验过程中可用pH试纸测定溶液的pH | |
| B. | a点的溶液中:C(H+)=c(Cl-)+c(HCl0)+c(OH-) | |
| C. | c 点所示溶液中;c(Na+)=2c(ClO )+c(HCIO) | |
| D. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 |
 将镁、铝的混合物共0.2mol,溶于200mL4mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:,
将镁、铝的混合物共0.2mol,溶于200mL4mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:,

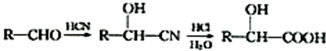
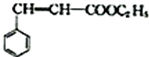
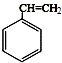 ;C 的化学名称为苯乙醛.
;C 的化学名称为苯乙醛.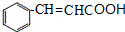 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O.
+H2O.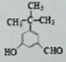
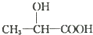 )的路线(其他试剂任选)
)的路线(其他试剂任选)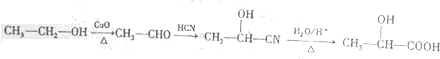 .
.