题目内容
6.将如图所示实验装置的K闭合,下列判断不正确的是( )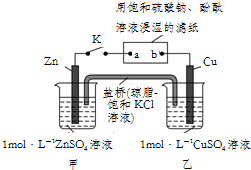
| A. | 盐桥中的Cl-向甲池移动,滤纸上的SO42-向b移动 | |
| B. | 电子流动沿Zn→a,b→Cu的路径 | |
| C. | Cu电极上的反应为:Cu2++2e-═Cu,滤纸a点发生还原反应 | |
| D. | 片刻后,甲池中c(Zn2+)增大,可观察到滤纸b点变红色 |
分析 依据装置图分析装置的K闭合,为原电池装置电解滤纸上的饱和硫酸钠溶液,甲和乙形成原电池反应锌做负极失电子发生氧化反应,铜做正极,a是阴极,b是负极;
A、原电池中阴离子移向负极,电解池中,阴离子移向阳极;
B、电子从原电池负极流出经外电路流向电解池阴极a,通过电解质溶液离子定向移动到b;电子不能通过电解质溶液;
C、Cu作原电池的正极,滤纸a点是阴极,都发生还原反应;
D、滤纸处是电解池,a做阴极,氢离子得到电子发生还原反应据此回答.
解答 解:A、Zn作原电池的负极,Cu作原电池的正极,盐桥中的Cl-向负极移动,即向着甲池移动,滤纸上的SO42-向阳极,即向着b移动,故A正确;
B、电子流向是负极到正极,电子不经过电解质,即沿Zn→a,b→Cu的路径,故B正确;
C、Cu作原电池的正极,电极上的反应为:Cu2++2e-═Cu,滤纸a点是阴极,发生还原反应,故C正确;
D、选项中是滤纸a点是阴极,氢离子放电,水电离平衡破坏附近氢氧根离子浓度增大,酚酞变红,故D错误;
故选D.
点评 本题考查电化学知识,原电池、电解池原理的应用,装置图设计有些复杂,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.关于苯的下列说法正确的是( )
| A. | 苯是1825年由俄国科学家门捷列夫发现的 | |
| B. | 苯与乙烯一样,是很重要的化工原料,可作消毒剂、有机溶剂、洗涤剂 | |
| C. | 苯的分子式中碳原子远没有饱和,因此能使溴水和高锰酸钾褪色 | |
| D. | 苯环上的碳碳键是一种介于单键和双键的独特的键,苯既能发生取代反应也能发生加成反应 |
14.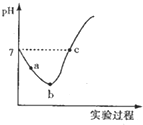 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
 常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol/L的NaOH溶液,整个实验过程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验过程中可用pH试纸测定溶液的pH | |
| B. | a点的溶液中:C(H+)=c(Cl-)+c(HCl0)+c(OH-) | |
| C. | c 点所示溶液中;c(Na+)=2c(ClO )+c(HCIO) | |
| D. | 由a点到b点的过程中,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 |
1.下列实验操作、实验现象和实验结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向酸性KMnO4溶液中滴加乙二酸 | 溶液褪色 | 乙二酸具有还原性 |
| B | 将Fe(NO3)2样品溶于稀H2SO4,滴加 KSCN溶液 | 溶液变红 | 稀硫酸能氧化Fe2+ |
| C | 向AgNO3溶液中滴加过量氨水 | 得到澄清溶液 | Ag+与NH3•H2O能大 量共存 |
| D | 向10mL 0.1mol•L-1 Na2S溶液中滴入2mL 0.1mol•L-1 ZnSO4溶液,再加入 2mL 0.1mol•L-1 CuSO4溶液 | 开始有白色沉淀生成;后有黑色沉淀生成 | Ksp(CuS)<Ksp(ZnS) |
| A. | A | B. | B | C. | C | D. | D |
11.分子式为C9H10O2,能与NaHCO3溶液反应放出CO2,且苯环上一氯代物有两种的有机物有(不考虑立体异构)( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
18.化学与生产、生活、社会密切相关.下列说法中正确的是( )
| A. | 地沟油不宜食用,可分馏提取汽油 | |
| B. | 二氧化硅具有很好的导电性,可用于制取光导纤维 | |
| C. | 盛有甲醇的试剂瓶上,应贴上 警示标签 警示标签 | |
| D. | 钙、钡、铁、铂等金属有绚丽的颜色,可用于制造焰火 |
15.锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门.以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是MnCO3+H2SO4=MnSO4+CO2↑+H2O;
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③抑制Mn2+的水解;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(4)步骤Ⅲ中,需要用到的玻璃仪器除玻璃棒、漏斗外,还有烧杯;滤渣2的主要成分是CoS和NiS;
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.欲使溶液中c(Mn2+)≤1.0×10-5 mol•L-1,则应保持溶液中c(S2-)≥1.0×10-6 mol•L-1.

已知25℃,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③抑制Mn2+的水解;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
加氨水调节溶液的pH为5.0~6.0,以除去Fe3+.
(4)步骤Ⅲ中,需要用到的玻璃仪器除玻璃棒、漏斗外,还有烧杯;滤渣2的主要成分是CoS和NiS;
(5)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降.欲使溶液中c(Mn2+)≤1.0×10-5 mol•L-1,则应保持溶液中c(S2-)≥1.0×10-6 mol•L-1.
16.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. | 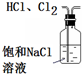 除去HCl中含有的少量Cl2 | B. |  石油的蒸馏 | ||
| C. |  制备乙酸乙酯 | D. |  制备收集干燥的氨气 |